第三节 氧化还原反应 知识点题库
晋葛洪《抱朴子内篇•黄白》记载“曾青涂铁,铁赤色如铜”(“曾青”是指硫酸铜).下列说法不正确的是( )
A . 记载中的反应属于置换反应
B . 记载中蕴含了湿法炼铜的原理
C . 由记载得出铁单质是赤色(红色)
D . 每生成1mol铜转移2mol电子
利用水钴矿[主要成分为Co2O3和Co(OH)3 , 还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
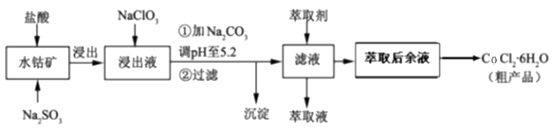 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
-
(1) 提高水钴矿浸出速率的措施有(填写两点),浸出过程中Co2O3发生反应的离子方程式为。
-
(2) NaClO3的作用是。
-
(3) 加Na2CO3调pH至5.2所得沉淀为。
-
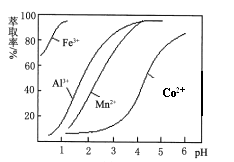
(4) 萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是;其使用的适宜pH范围是。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
-
(5) 由萃取后余液获得粗产品的操作步骤为。
下列离子方程式正确的是( )
A . Fe3O4溶于足量稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
B . 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
C . MnO2与浓盐酸反应制Cl2:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
D . 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
Mn2++Cl2↑+2H2O
D . 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
下列制备单质的方法中,需要加入还原剂才能实现的是( )
A . 高炉炼铁
B . 电解法制金属镁
C . 加热氧化汞制金属汞
D . 从海带灰浸取液中(含I-)提取碘单质
下列转化过程中必须加入还原剂的是( )
A . FeS→H2S
B . SO2→SO32-
C . Fe3+→Fe2+
D . Cu→Cu2+
已知在某温度时发生如下三个反应:
①C+CO2=2CO ②C+H2O(g)=CO+H2 ③CO+H2O=CO2+H2
由此可判断,在该温度下,C、CO、H2 的还原性的顺序是( )
A . CO>C>H2
B . CO>H2>C
C . C>H2>CO
D . C>CO>H2
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )
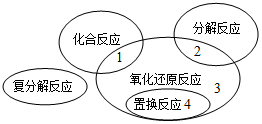
A . 4FeS2+11O2  2Fe2O3+8SO2
B . 2Na+Cl2
2Fe2O3+8SO2
B . 2Na+Cl2  2NaCl
C . Zn+CuSO4=ZnSO4+Cu
D . 2KMnO4
2NaCl
C . Zn+CuSO4=ZnSO4+Cu
D . 2KMnO4  K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
 2Fe2O3+8SO2
B . 2Na+Cl2
2Fe2O3+8SO2
B . 2Na+Cl2  2NaCl
C . Zn+CuSO4=ZnSO4+Cu
D . 2KMnO4
2NaCl
C . Zn+CuSO4=ZnSO4+Cu
D . 2KMnO4  K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
硫酸铵在加热条件下分解生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是( )
A . 1:3
B . 2:3
C . 1:1
D . 3:1
按要求填空:
-
(1) 写出新制氯水中含量最多的微粒的化学式(水分子除外)
-
(2) 写出漂白粉中有效成分的名称
-
(3) 描述检验溶液中K+离子的实验操作过程
-
(4) 配平下列化学方程式
()Cu+()HNO3(稀)=()Cu(NO3)2+()NO↑+()H2O
-
(5) 按照物质的分类,次磷酸(H3PO2)属于二元酸,其与足量的NaOH溶液反应的化学方程式为
一定条件下,氨气与一氧化氮发生反应4NH3+6NO=5N2+6H2O。该反应中化合价降低的元素是( )
A . NH3中的N
B . NO中的O
C . NO中的N
D . NH3中的H
设NA阿伏加德罗常数的值,下列说法错误的是( )
A . 10g的2H216O含有的质子数与中子数均为5NA
B . 32g硫在足量的氧气中充分燃烧,转移电子数为6NA
C . 26gC2H2与C6H6混合气体中含C—H键的数目为2NA
D . 120gNaHSO4和KHSO3的固体混合物中含有的阳离子数为NA
下表是四个反应的有关信息:
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
下列结论正确的是( )
A . 第①组反应的氧化产物一定只有FeCl3(实为Fe3+)
B . 第③组反应的产物还有KCl和H2O
C . 氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
D . 还原性比较:H2O2>Mn2+>Cl-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO = 2Na2FeO4+9NaCl+5H2O ②Na2FeO4 + 2KOH = K2FeO4 + 2NaOH,下列说法错误的是( )
A . 反应①②均为非氧化还原反应
B . 反应①中NaClO 是氧化剂
C . Na2FeO4 中Fe为+4价,具有强氧化性,能杀菌消毒
D . 若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol
下列叙述不涉及氧化还原反应的是( )
A . 氮的固定
B . 氢氟酸雕刻玻璃
C . 粗硅的提纯
D . 大气中NO2参与酸雨形成
一种三电极电解水制氢的装置如图,三电极为催化电极a、催化电极b和  电极。通过控制开关连接
电极。通过控制开关连接  或
或  ,可交替得到
,可交替得到  。下列说法错误的是( )
。下列说法错误的是( )
 电极。通过控制开关连接
电极。通过控制开关连接  或
或  ,可交替得到
,可交替得到  。下列说法错误的是( )
。下列说法错误的是( ) 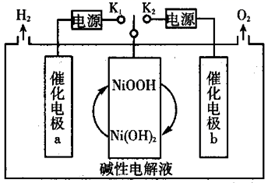
A . 制  时,电子由
时,电子由  电极通过外电路流向催化电极b
B . 制
电极通过外电路流向催化电极b
B . 制  时,阳极的电极反应式为:Ni(OH)2+OH-_e-=NiOOH+H2O
C . 若该电路中生成标况下22.4L
时,阳极的电极反应式为:Ni(OH)2+OH-_e-=NiOOH+H2O
C . 若该电路中生成标况下22.4L  ,电子转移数目为4NA
D . 该装置可在无隔膜的条件下制备高纯氢气
,电子转移数目为4NA
D . 该装置可在无隔膜的条件下制备高纯氢气
 时,电子由
时,电子由  电极通过外电路流向催化电极b
B . 制
电极通过外电路流向催化电极b
B . 制  时,阳极的电极反应式为:Ni(OH)2+OH-_e-=NiOOH+H2O
C . 若该电路中生成标况下22.4L
时,阳极的电极反应式为:Ni(OH)2+OH-_e-=NiOOH+H2O
C . 若该电路中生成标况下22.4L  ,电子转移数目为4NA
D . 该装置可在无隔膜的条件下制备高纯氢气
,电子转移数目为4NA
D . 该装置可在无隔膜的条件下制备高纯氢气
NA是阿伏加德罗常数的值。下列说法正确的是( )
A . 32gO2中所含的质子数为32NA
B . 25℃时,pH=12的NaOH溶液中OH-数目为0.01NA
C . 100g3.4%的H2O2溶液中所含的极性键数目为0.2NA
D . 标准状况下,H2和CO的混合气体22.4L完全燃烧,转移的电子数为2NA
足量Cu与一定量浓硝酸反应,生成硝酸铜和NO、NO2的混合气体。这些气体和1.68L氧气(标况下)恰好完全溶解在100mL2mol/L的NaOH溶液中得到NaNO3溶液,下列有关说法正确的是( )
A . 反应过程中NaOH是还原剂
B . 反应中溶解19.2g铜
C . NO和NO2的物质的量之和可能为0.4mol
D . 原溶液浓硝酸中n(HNO3)=0.5mol
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.12LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A . 60mL
B . 50mL
C . 45mL
D . 30mL
单质疏在热的 溶液中发生歧化反应:
溶液中发生歧化反应: 。若硫过量,会进一步发生反应:
。若硫过量,会进一步发生反应: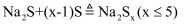 ,
, 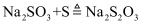 。将
。将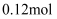 疏与含
疏与含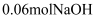 的热溶液充分反应恰好生成
的热溶液充分反应恰好生成 和
和 , 向该溶液中再加入适量
, 向该溶液中再加入适量 碱性溶液
碱性溶液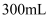 , 硫元素恰好全部转化为
, 硫元素恰好全部转化为 , 下列说法错误的是( )
, 下列说法错误的是( )
 溶液中发生歧化反应:
溶液中发生歧化反应: 。若硫过量,会进一步发生反应:
。若硫过量,会进一步发生反应: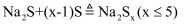 ,
, 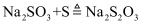 。将
。将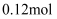 疏与含
疏与含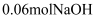 的热溶液充分反应恰好生成
的热溶液充分反应恰好生成 和
和 , 向该溶液中再加入适量
, 向该溶液中再加入适量 碱性溶液
碱性溶液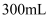 , 硫元素恰好全部转化为
, 硫元素恰好全部转化为 , 下列说法错误的是( )
, 下列说法错误的是( )
A . 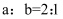 B .
B .  碱性溶液的物质的量浓度为
碱性溶液的物质的量浓度为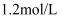 C .
C .  中
中 D . 生成
D . 生成 溶液的物质的量浓度为
溶液的物质的量浓度为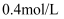
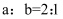 B .
B .  碱性溶液的物质的量浓度为
碱性溶液的物质的量浓度为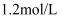 C .
C .  中
中 D . 生成
D . 生成 溶液的物质的量浓度为
溶液的物质的量浓度为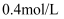
下列用双线桥法表示反应中电子转移正确的是( )
A .  B .
B . 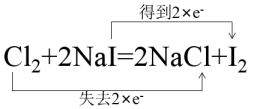 C .
C . 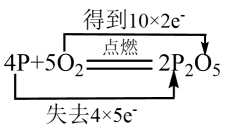 D .
D . 
 B .
B .  C .
C .  D .
D . 
最近更新



