第三节 氧化还原反应 知识点题库
有NH4+、Fe3+、NO3﹣、Fe2+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物.
(1)氧化剂与还原剂的物质的量之比为
(2)若有1mol NO3﹣参加反应,则转移 mol e﹣
(3)若把该反应设计为原电池,则负极反应为 .
按要求回答下列问题.
-
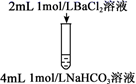
(1) KMnO4作为强氧化剂,其氧化性随溶液的酸性增强而增大,在酸性介质中还原产物是Mn2+ , 在中性或碱性介质中还原产物主要是MnO2 , 试写出KMnO4在酸性条件下将H2O2氧化的离子方程式:.
-
(2) 工业上可用KClO3溶液与Na2SO3溶液在稀H2SO4存在下制得ClO2气体,试写出该反应的离子方程式:.
-
(3) 在强酸性混合稀土溶液中加入H2O2 , 可以将溶液中Ce3+氧化成Ce(OH)4沉淀得以分离,完成该反应的离子方程式:.
-
(4) H3PO2的工业制法是将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2 , 后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式:.
草酸合铁(Ⅲ)酸钾的体Kx[Fey(C2O4)z] ·nH2O 可用于摄影和蓝色印刷。为确定其组成,某化学兴趣小组在没有氧气干扰下进行如下实验:
实验I.草酸根含量的测定
称取0.9820g样品放入锥形瓶中,加入适量稀硫酸和一定量水,加热至343~358K,用0.2000mol/L KMnO4溶液滴定,滴定过程中草酸转变成CO2逸出反应容器,KMnO4转变成Mn2+。达到滴定终点时,共消耗KMnO4 溶液12.00 mL。
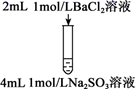
实验II. 铁含量的测定
将上述滴定过的保留液充分加热,使淡紫红色消失。冷却后,调节溶液pH并加入过量的KI固体,充分反应后调节pH至7左右,滴入几滴淀粉溶液作指示剂,用0.2500mol/LNa2S2O3标准溶液滴定至终点。共消耗Na2S2O3溶液8.00mL.(已知: 实验II中涉及的部分离子方程式为I2+2S2O32-=2I-+S4O62-)
请根据上述实验回答下列问题:
-
(1) 实验I在滴定过程中反应的离子方程式为。
-
(2) MnO4-在酸性条件下,加热能分解为O2 , 同时生成Mn2+ , 若实验II中没有对实验I的保留液进行充分加热,则测定的Fe3+的含量将会(填“偏高”、“偏低”或“不变”。)
-
(3) 实验II用淀粉溶液作指示剂,则滴定终点观察到的现象为。
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为2Cu+H2O  Cu2O+H2↑。下列说法正确的是( )
Cu2O+H2↑。下列说法正确的是( )
 Cu2O+H2↑。下列说法正确的是( )
Cu2O+H2↑。下列说法正确的是( ) 
A . 石墨电极上产生氢气
B . 铜电极发生还原反应
C . 铜电极接直流电源的负极
D . 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中,正确的是()
A . Cu既是氧化产物又是还原产物
B . 该反应的氧化剂只有Cu2O
C . Cu2S在反应中既是氧化剂,又是还原剂
D . 每生成19.2gCu,反应中转移0.6mol电子
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
-
(1) A中反应的离子方程式是。
-
(2) 实验操作Ⅱ吹入热空气的目的是。
-
(3) 装置C的作用是,C中盛放的药品是。
-
(4) 实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式。
-
(5) 由上述实验得出的结论是。
-
(6) 实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):。
下列变化需要加入还原剂才能实现的是( )
A . HCl→Cl2
B . Fe→Fe3+
C . KClO3→O2
D . KMnO4-→Mn2+
现用 0.1000mol/L KMnO4 酸性溶液滴定未知浓度的无色 H2C2O4 溶液(体积为 20.00mL)。请回答下列问题
-
(1) 该反应的离子方程式是。
-
(2) 盛放高锰酸钾溶液的是 (填“酸式”或“碱式”)滴定管,其原因是。
-
(3) 滴定终点的现象为。
-
(4) 若某次滴定开始和结束时,滴定管中的液面如图所示,则终点的读数为mL。小明同学根据 3 次实验求得平均消耗高锰酸钾溶液的体积为 VmL,请计算该 H2C2O4溶液的物质的量浓度为mol/L

-
(5) 下列操作使测定结果偏低的是___(填字母)。A . 酸式滴定管未用标准液润洗直接注入 KMnO4标准液 B . 滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 C . 酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡 D . 读取 KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
由两种元素组成的矿物A,测定A的组成及制取化合物D的流程如图:

请回答:
-
(1) A的化学式为
-
(2) 写出③的离子方程式:
-
(3) 写出D溶于足量稀硝酸的化学方程式:
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为  B . 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C . 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
D . 某电池的总反应为Fe+2Fe3+=3Fe2+,当有5.6gFe溶解时电路中有0.2mol e-通过
B . 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C . 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
D . 某电池的总反应为Fe+2Fe3+=3Fe2+,当有5.6gFe溶解时电路中有0.2mol e-通过
 B . 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C . 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
D . 某电池的总反应为Fe+2Fe3+=3Fe2+,当有5.6gFe溶解时电路中有0.2mol e-通过
B . 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C . 1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
D . 某电池的总反应为Fe+2Fe3+=3Fe2+,当有5.6gFe溶解时电路中有0.2mol e-通过
下列古诗词描述的场景中发生的化学反应不属于氧化还原反应的是( )
A . 爆竹声中一岁除——黑火药受热爆炸
B . 烈火焚烧若等闲——石灰石分解
C . 蜡炬成灰泪始干——石蜡的燃烧
D . 炉火照天地,红星乱紫烟——铁的冶炼
已知 aM2++bO2 + 4H+=cM3++dH2O,则化学计量数 c 的值为( )
A . 1
B . 2
C . 3
D . 4
下列应用利用了氧化还原反应原理的是( )
A . 用酒精擦去衣服上的油迹
B . 用生石灰作干燥剂
C . 食品包装袋中放置铁粉包防止食品变质
D . 用稀盐酸除去铁锈
下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论错误的是( )
| 实验① | 实验② | 实验③ |
| | | |
A . 实验①中生成的沉淀是BaCO3
B . 实验①中有气体生成
C . 实验②沉淀中可能含有BaSO4
D . 实验③生成沉淀的离子方程式是:Ba2++ H2SO3=BaSO3↓+2H+
水热法制备  纳米颗粒的总反应为
纳米颗粒的总反应为  下列说法正确的是( )
下列说法正确的是( )
 纳米颗粒的总反应为
纳米颗粒的总反应为  下列说法正确的是( )
下列说法正确的是( )
A .  、
、  都是氧化剂
B .
都是氧化剂
B . 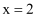 C . 每转移3mol电子,有
C . 每转移3mol电子,有  被氧化
D . 氧化产物只有
被氧化
D . 氧化产物只有 
 、
、  都是氧化剂
B .
都是氧化剂
B . 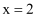 C . 每转移3mol电子,有
C . 每转移3mol电子,有  被氧化
D . 氧化产物只有
被氧化
D . 氧化产物只有 
亚氯酸钠(NaClO2)是一种高效含氯消毒剂和漂白剂,主要用于自来水、污水等水环境的杀菌消毒,也常用作纸浆、砂糖、油脂的漂白剂。图为目前生产亚氯酸钠的流程之一(夹持装置省略),所得NaClO2具有纯度高的优点。

已知:NaClO2饱和溶液在低于38℃时会析出NaClO•3H2O,高于38℃时析出NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl。
试回答下列问题:
-
(1) 仪器a的名称为。
-
(2) 装置A用来制取ClO2 , 发生反应的离子方程式为。
-
(3) 研究测得C装置吸收液中的c(NaOH)与
 对粗产品中NaClO2含量的影响如图所示。则最佳条件为c(NaOH)=mol/L,
对粗产品中NaClO2含量的影响如图所示。则最佳条件为c(NaOH)=mol/L,  =。
=。 
-
(4) C装置采用“冰水浴”的目的是。
-
(5) 充分反应后,为从产品溶液中获取NaClO2晶体,从下列选项中选出合理的操作并排序:( )→( )→( )→干燥,
a.趁热过滤 b.50℃水洗涤 c.加热蒸发结晶 d.冰水洗涤 e.55℃恒温减压蒸发结晶
-
(6) 在化学定分析中为了方便计算,常用滴定度(T)表示标准液的滴定能力,是指每毫升标准溶液相当于样品中所含被测物质的质量。准确称取一定质量的NaClO2(摩尔质量为Mg/mol)样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:
 ,得待测溶液。取一定量消耗待测溶液,以淀粉溶液作指示剂,消耗
,得待测溶液。取一定量消耗待测溶液,以淀粉溶液作指示剂,消耗 
 标准液V mL(已知:
标准液V mL(已知:  )。则滴定度T=g/mL。
)。则滴定度T=g/mL。
酸性条件下,可发生反应:M2O  +6Cl-+14H+=3Cl2↑+2M3++7H2O,则M2O
+6Cl-+14H+=3Cl2↑+2M3++7H2O,则M2O  中M化合价是( )
中M化合价是( )
 +6Cl-+14H+=3Cl2↑+2M3++7H2O,则M2O
+6Cl-+14H+=3Cl2↑+2M3++7H2O,则M2O  中M化合价是( )
中M化合价是( )
A . +4
B . +5
C . +6
D . +7
捕获二氧化碳是碳中和技术之一,如图2是捕获二氧化碳生成甲酸的过程,N(C2H3)3性质与NH3类似。若NA为阿伏加德罗常数的值,下列说法正确的是( )

A . 若有22.4LCO2参与反应,则拆开CO2分子中共用电子对的数目为4NA
B . 0. 1mol N(C2H3)3与盐酸恰好完全反应所得盐溶液中
[N( C2H3)3H]+的数目为0.1NA
C . 每生成1mol甲酸,该捕获过程中转移的电子数为2NA D . 1mol 甲酸和足量乙醇充分反应后,生成甲酸乙酯的数目为NA (
(  )极易水解,主要用于制备酰基氯化物。下列关于
)极易水解,主要用于制备酰基氯化物。下列关于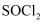 说法错误的是( )
说法错误的是( )
A . 既有氧化性又有还原性
B . 遇水反应生成 和
和 C . 可用作由
C . 可用作由 制取无水
制取无水 的脱水剂
D .
的脱水剂
D . 
 和
和 C . 可用作由
C . 可用作由 制取无水
制取无水 的脱水剂
D .
的脱水剂
D . 
高锰酸钾与浓盐酸在一定条件下可以反应生成氯气:2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
-
(1) 用双线桥法表示出该反应中的电子转移。
-
(2) 该反应中,氧化剂与还原剂的物质的量之比为;KMnO4的氧化性比Cl2的氧化性 (填“弱”或“强”)。
-
(3) 15.8g高锰酸钾与足量浓盐酸反应,产生的氯气在标况下的体积为L。(写出计算过程)
最近更新