第三章 金属及其化合物 知识点题库
关于下列图象的说法正确的是( )[注:E﹣能量,p﹣压强,t﹣时间,V﹣体积]

A . ①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ/mol
B . ②表示其它条件不变时,反应 4A(g)+3B(g)⇌2C(g)+6D在不同压强下 B的体积分数随时间的变化,则D一定是气体
C . ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a曲线表示CH3COOH溶液
D . ④表示分别向同为10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,逐滴滴加0.1mol/L 盐酸,所产生CO2的体积随盐酸体积的变化情况,则b曲线表示Na2CO3溶液
A为两种金属组成的合金,发生如图所示的变化:
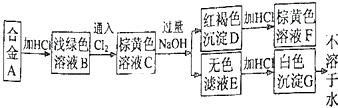
-
(1) 合金A由和组成;
-
(2) 写出下列变化的离子方程式:
C→E;
D→F.
某无色透明溶液中可能大量存在Na+、Mg2+、Ag+、Cu2+、Fe3+阳离子中的一种或几种,请填写下列空白:
-
(1) 不做任何实验就可以肯定原溶液中不存在的离子是:.
-
(2) 取少量原溶液,加入过量的稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失.说明原溶液中一定存在的离子是:,有关的离子方程式;
-
(3) 取(2)中的滤液,加入过量的NaOH出现白色沉淀,说明原溶液肯定有,有关的离子方程式;
-
(4) 原溶液还可能大量存在的阴离子是 .A . Cl﹣ B . NO3﹣ C . CO32﹣ D . OH﹣ .
下列各组物质相互作用时,生成物不随反应条件或反应物的量变化而变化的是( )
A . Na和O2
B . NaOH和CO2
C . NaHCO3和NaOH
D . Na2CO3和HCl
下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②AlCl3 ③Al2O3 ④Al(OH)3 ⑤Al.
A . ③④
B . ③④⑤
C . ①③④⑤
D . 全部
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
①Cu位于元素周期表第ⅠB族.Cu2+的核外电子排布式为.
②Cu2O的熔点比Cu2S的(填“高”或“低”),请解释原因.
下列推断合理的是( )
A . 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B . 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C . 常温下Fe、Al遇浓HNO3发生钝化,故Fe、Al不能与浓HNO3发生反应
D . 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
在给定条件下,下列物质间转化均能实现的是( )
A . S  SO3
SO3  H2SO4
B . 粗硅
H2SO4
B . 粗硅  SiCl4
SiCl4  Si
C . NH3
Si
C . NH3 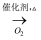 NO
NO  HNO3
D . Cu
HNO3
D . Cu  CuS
CuS 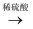 H2S
H2S
 SO3
SO3  H2SO4
B . 粗硅
H2SO4
B . 粗硅  SiCl4
SiCl4  Si
C . NH3
Si
C . NH3 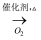 NO
NO  HNO3
D . Cu
HNO3
D . Cu  CuS
CuS 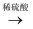 H2S
H2S
下列解释实验现象的反应方程式正确的是()
A . 切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2=Na2O2
B . 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl-
C . Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na2O2+CO2=2Na2CO3+O2
D . FeCl2溶液中滴加NaClO溶液生成红褐色沉淀:2Fe2++ ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+
下列实验中,对应的现象及结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液一定为钠盐溶液 |
| B | 用浓盐酸和石灰石反应产生的气体直接通入Na2SiO3溶液中 | Na2SiO3溶液变浑浊 | C元素的非金属性大于Si元素 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 向某溶液中加入稀硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中一定存在SO42- |
A . A
B . B
C . C
D . D
下面关于金属钠的描述错误的是( )
A . 钠是电和热的良导体
B . 将Na投入盐酸中,Na先与水反应,生成的NaOH再与HCl反应
C . 钠的化学性质很活泼,在自然界里不能以游离态存在
D . 钠和钾的合金在室温下呈液态,可做原子反应堆的导热剂
铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用基准试剂,其制备过程如下。下列分析错误的是( )

A . 过程Ⅰ反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4
B . 检验溶液B中阴离子的试剂仅需BaCl2溶液
C . 若省略过程Ⅱ,则铵明矾产率明显减小
D . 向铵明矾溶液中逐滴加入NaOH溶液并加热,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
一定温度下,探究铜与稀HNO3的反应,反应过程如下:

下列说法错误的是( )
A . 过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
B . 步骤III反应速率比I 快的原因一定是NO2溶于水,使c(HNO3)增大
C . 过程Ⅱ中气体变成红棕色的反应为2NO+O2=2NO2
D . 当活塞不再移动时,再抽入空气,铜可以继续溶解
CO2、CO作为碳源,可以制备多种有机化合物,在能源结构方面具有重要意义。回答下列问题:
-
(1) CO2的电子式为。
-
(2) 一定条件下,CO与H2可化合生成甲醇(CH3OH),该反应的化学方程式为。
-
(3) 利用CO2可合成聚碳酸酯(易降解),反应原理如下:

从环境角度来看,用聚碳酸酯塑料代替聚乙烯和聚苯乙烯传统塑料的最大优点是。
-
(4) 研究表明,相对原子质最小的金属氧化时,都可以获得高的燃烧热,从而可解决二氧化碳的排放问题。其中镁粉作燃料时还可消除过量的二氧化碳,其原因是(用化学方程式解释)。
-
(5) 最近我国科学家采用In2O3/分子筛催化剂,实现了CO2加氢一步转化有机物X,化学式为C6H14 , 该物质一氯代物有2种,X的结构简式为。
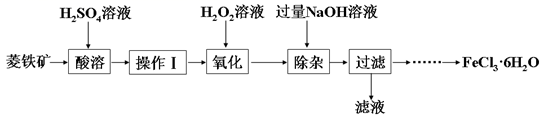
某化学兴趣小组以菱铁矿(主要成分为FeCO3 , 含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:
-
(1) 酸溶及后续过程中均需保持酸过量,其目的除了提高铁元素的浸出率之外,还有。
-
(2) 操作Ⅰ名称是。
-
(3) 滴加H2O2溶液氧化时,发生主要反应的离子方程式为。
-
(4) 在氧化过程中,如何检验铁元素全部以Fe3+形式存在:。
-
(5) 加入过量NaOH溶液的目的是。
-
(6) 请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
下列有关实验的操作错误的是( )
A . 做金属钠的相关实验时,多余的钠要放回广口瓶
B . 焰色试验使用的铂丝也可以用细铁丝代替
C . 在饱和食盐水中依次通入足量的 CO2和 NH3后有 NaHCO3晶体析出
D . 常用 NaOH 溶液吸收硝酸反应的尾气 NO2
现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:

有关说法错误的是( )
A . 反应Ⅰ原理为CO2 + NH3 + NaCl + H2O → NaHCO3↓ + NH4Cl
B . 向饱和NaCl溶液中先通入足量的CO2 , 再通入足量的NH3
C . 反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱
D . 往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出
下列说法正确的是( )
A . 食物腐败、 胶体净水、植物光合作用都与氧化还原反应有关
B .
胶体净水、植物光合作用都与氧化还原反应有关
B .  可用于文物鉴定,
可用于文物鉴定, 与
与 互为同素异形体
C . 既能与酸反应又能与碱反应的化合物属于两性氧化物
D . 镧镍合金能大量吸收
互为同素异形体
C . 既能与酸反应又能与碱反应的化合物属于两性氧化物
D . 镧镍合金能大量吸收 形成金属氢化物,可作储氢材料
形成金属氢化物,可作储氢材料
 胶体净水、植物光合作用都与氧化还原反应有关
B .
胶体净水、植物光合作用都与氧化还原反应有关
B .  可用于文物鉴定,
可用于文物鉴定, 与
与 互为同素异形体
C . 既能与酸反应又能与碱反应的化合物属于两性氧化物
D . 镧镍合金能大量吸收
互为同素异形体
C . 既能与酸反应又能与碱反应的化合物属于两性氧化物
D . 镧镍合金能大量吸收 形成金属氢化物,可作储氢材料
形成金属氢化物,可作储氢材料
下列说法不正确的是( )
A . 过氧化钠可在呼吸面具或潜水艇中作为氧气的来源
B . 稀土金属可广泛应用在冶金、石油化工、材料工业等领域
C . 铁强化酱油可以减少缺铁性贫血问题的发生
D . 节日烟花所呈现的就是钠、钾、钡等金属单质的焰色
草酸亚铁晶体是生产感光材料的原料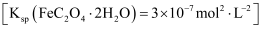 , 制备流程如下:
, 制备流程如下:
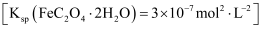 , 制备流程如下:
, 制备流程如下:
下列说法错误的是( )
A . 可用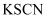 溶液检验
溶液检验 是否变质
B . 步骤①酸化的目的是抑制
是否变质
B . 步骤①酸化的目的是抑制 的水解
C . 步骤②反应为
的水解
C . 步骤②反应为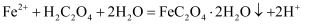 D . 步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D . 步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
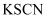 溶液检验
溶液检验 是否变质
B . 步骤①酸化的目的是抑制
是否变质
B . 步骤①酸化的目的是抑制 的水解
C . 步骤②反应为
的水解
C . 步骤②反应为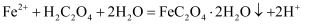 D . 步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D . 步骤③为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
最近更新



