第三章 金属及其化合物 知识点题库
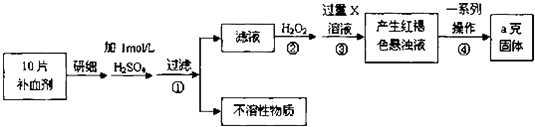
请回答下列问题:
-
(1) 步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有(填离子符号),检验滤液中还存在Fe2+的方法为(注明试剂、现象).
-
(2) 步骤②加入过量H2O2的目的是.
-
(3) 步骤③中反应的离子方程式为
-
(4) 步骤④中一系列处理的操作步骤包括:过滤、、灼烧、、称量.
-
(5) 若实验无损耗,则每片补血剂含铁元素的质量为 g.
①纯铁不容易生锈 ②钠着火用水扑灭 ③铝在空气中耐腐蚀,所以铝是不活泼金属 ④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金 ⑥KSCN溶液可以检验Fe3+离子 ⑦Al和Fe都能与某些氧化物反应.
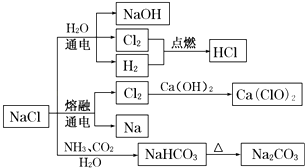
 Na2CO3+H2O+CO2↑
C . 电解饱和氯化钠溶液的方程式为:2NaCl
Na2CO3+H2O+CO2↑
C . 电解饱和氯化钠溶液的方程式为:2NaCl  2Na+Cl2↑
D . 图中所示转化反应都是氧化还原反应
2Na+Cl2↑
D . 图中所示转化反应都是氧化还原反应

请回答下列问题:
-
(1) 沉淀B的成分是(填化学式,下同);
-
(2) 沉淀C的成分是;
-
(3) 沉淀F转化为物质M的化学方程式为 ;
-
(4) 溶液D中通入过量CO2生成沉淀F的离子方程式为。
| A | B | C | D | |
| 实验 | NaOH 溶液滴入FeSO4 溶液中 | 石蕊溶液滴入氯水中 | 向 K2Cr2O7 溶液 中滴加浓硫酸 | CO2 通入 Na2O2 |
| 现象 | 产生白色沉淀,最 终变为红褐色 | 溶液变红,随后迅速褪色 | 溶液黄色变浅, 橙色加深 | 固体逐渐变白 |
-
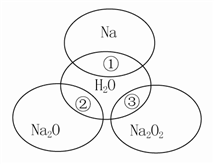
(1) I.现有下列10种物质①熔融的氢氧化钠 ②蔗糖 ③纯净的盐酸 ④金属钠 ⑤硫酸 ⑥二氧化硫 ⑦硫粉 ⑧石膏(CaSO4·2 H2O) ⑨酒精溶液 ⑩液氨
属于电解质的有。
-
(2) 属于非电解质的有。
-
(3) 上述状态下能导电的有。
-
(4) 上述状态下的电解质不能导电的有。
-
(5) II.Fe(OH)2长时间露置于空气中发生变化的化学方程式为:。
偏铝酸钠溶液中通入足量二氧化碳反应的离子方程式为:。
-
(6) III.高纯度单晶硅可以按下列方法制备:
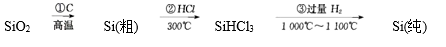
写出步骤①的化学方程式。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃),提纯SiHCl3主要操作的名称是。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
-
(1) 若A常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是;
②在工业生产中B气体的大量排放被雨水吸收后形成而污染了环境。
-
(2) 若A在常温下为气体,C是红棕色的气体.
①A、C的化学式分别是:A;C。
② C→D反应的化学方程式 ;该反应(填“属于”或“不属于”)氧化还原反应。
![]()
| X | Y | Z | |
| A | H2S | S | SO2 |
| B | NH3 | NO | NO2 |
| C | Fe | FeCl2 | FeCl3 |
| D | Mg | C | CO |
 2MgO+C
B . 一水合氨在水中的电离方程式:NH3·H2O=NH
2MgO+C
B . 一水合氨在水中的电离方程式:NH3·H2O=NH  +OH-
C . 氯化铁水解的离子方程式:Fe3++3H2O
+OH-
C . 氯化铁水解的离子方程式:Fe3++3H2O  Fe(OH)3+3H+
D . 乙醇在铜催化下被氧化的化学方程式:2CH3CH2OH+O2
Fe(OH)3+3H+
D . 乙醇在铜催化下被氧化的化学方程式:2CH3CH2OH+O2  2CH3CHO+2H2O
2CH3CHO+2H2O
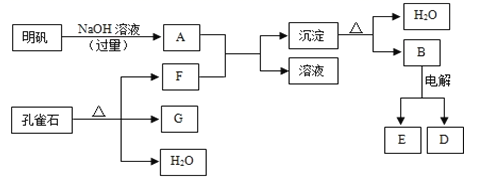
请填写下列空白:
-
(1) 孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,图中的F是(填化学式)。
-
(2) 写出明矾溶液与过量NaOH溶液反应的离子方程式:。
-
(3) 图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式,该反应消耗了3 molG,则转移的电子数是。
 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
-
(1) 工业上,将
 和
和 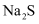 以
以 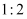 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入  可制取
可制取  ,同时放出
,同时放出  ,写出该反应的化学方程。
,写出该反应的化学方程。 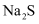 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为。
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为。
-
(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因。
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因。
-
(3) 下列关于苏打和小苏打的说法正确的是___________(选填字母序号)。A . 纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用 B . 苏打和小苏打的相互转化属于可逆反应 C . 苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确 D . 牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
-
(4) 向
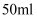 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 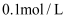 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。 
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是(填写化学式)
②滴入
 稀盐酸过程中,溶液导电性(填“增强”或“减弱”),试解释其原因。
稀盐酸过程中,溶液导电性(填“增强”或“减弱”),试解释其原因。③原
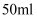 氢氧化钠溶液的浓度为。
氢氧化钠溶液的浓度为。
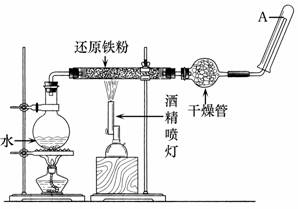
请回答该实验中的问题。
-
(1) 写出该反应的化学方程式。
-
(2) 实验前必须对整套装置进行的操作是。
-
(3) 干燥管中盛装的物质可以是,作用是。
-
(4) 试管中收集到的气体是,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是。
|
实验一 |
现象 |
|
| 一段时间后,培养皿中由铜片向外侧依次呈现: A区澄清且几乎无色; B区底部覆盖棕黑色固体; C区澄清且紫色变浅 |
资料:a.  在酸性溶液中不能稳定存在:
在酸性溶液中不能稳定存在: 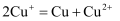
b. 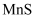 为粉红色沉淀、溶于强酸;
为粉红色沉淀、溶于强酸;  为黑色沉淀、不溶于强酸
为黑色沉淀、不溶于强酸
-
(1)
 被氧化成,依据是。
被氧化成,依据是。
-
(2) 为探究
 的还原产物,取A区中溶液(填操作和现象),证明有
的还原产物,取A区中溶液(填操作和现象),证明有  生成。
生成。
-
(3) A区中
 与
与  反应的离子方程式是。
反应的离子方程式是。
-
(4) 经检验,B区的棕黑色固体是
 ,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:。
,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:。
-
(5) 小组同学又进行了以下定量实验:
实验一
现象
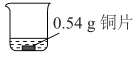

 酸性溶液
酸性溶液一段时间后,铜片质量减少了0.02g,溶液中无固体析出、溶液紫色变浅
通过计算,分析溶液紫色变浅而未完全褪色的原因:。
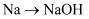 B .
B .  C .
C .  D .
D . 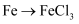

请回答:
-
(1) 出A、B和C的化学式:A,B,C。
-
(2) 写出由F→H的化学方程式:。
-
(3) 依次写出A→D的离子方程式:;

 酸性溶液
酸性溶液


