第二节 金属的腐蚀和防护 知识点题库

部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )



部分阳离子完全沉淀时溶液的pH如下:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答如下问题:
-
(1) 碱浸的目的是为了除去
-
(2) 某学习小组在实验室中模拟上述流程,简述洗涤滤渣①的操作
-
(3) 加入H2O2并保温一段时间过程中,保温的温度不宜过高的原因为,加入H2O2发生反应的离子方程式为。加入H2O2保温后调pH,下列范围合理的是(填选项序号)。
A.1.8~3.2
B.2.0~3.0
C.3.3~5.2
D.9.2~9.7
-
(4) 滤渣③的主要成分为,滤液③调pH为2~3的目的为
-
(5) 为测定产品中NiSO4·7H2O纯度,某同学将一定量的样品溶于水,再向其中加入足量的BaCl2溶液,过滤、洗涤沉淀并干燥,称量质量。通过计算发现产品中NiSO4·7H2O的质量分数大于100%,其可能的原因为
-
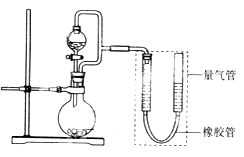
(1) (实验一)探究影响化学反应速率的因素。
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2。
序号
V(H2SO4)/mL
c(H2SO4)/mol·L-1
t/s
I
40
1
t1
II
40
3
t2
序号
V(H2SO4)/mL
c(H2SO4)/mol·L-1
t/s
I
40
1
t1
II
40
3
t2
检查该装置气密性的方法是。
比较实验I和Ⅱ可以得出的结论是。
-
(2) (实验二)探究铁的电化学腐蚀。
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面右侧液面(选填“上升”、“下降”)。
②圆底烧瓶中装与①相同量的铁粉但不加入碳粉,其他试剂和操作相同,发现左、右侧液面变化较(选填“快”、“慢”,下同),说明原电池反应比一般化学反应。
③圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:,正极的电极反应是。


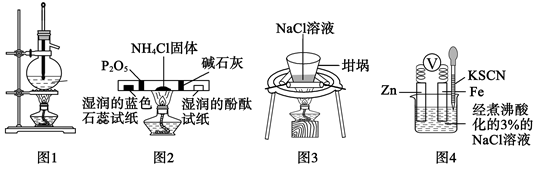
| 选项 | 实验操作和现象 | 结论 |
| A | 在一块已除锈的铁片上滴1滴含有酚酞的食盐水,静置2~3min,溶液边缘出现红色 | 铁片上发生了吸氧腐蚀 |
| B | 向pH=3的醋酸溶液中,加入少量醋酸铵固体,溶液pH增大 | 醋酸铵溶液呈碱性 |
| C | 用蘸有浓氨水的玻璃棒靠近试剂瓶瓶口,试剂瓶瓶口有白烟生成 | 该试剂瓶中盛装的是浓盐酸 |
| D | 将大理石与稀盐酸反应得到的气体直接通入足量澄清石灰水中,澄清石灰水变浑浊 | Cl的非金属性比C的强 |
 均会破坏铝表面的氧化膜
C . 工业制备硫酸的主要设备为沸腾炉、接触室和吸收塔
D . NO是一种无色、无味的气体,达到一定浓度时有毒,对人有害无利
均会破坏铝表面的氧化膜
C . 工业制备硫酸的主要设备为沸腾炉、接触室和吸收塔
D . NO是一种无色、无味的气体,达到一定浓度时有毒,对人有害无利



