第二节 燃烧热 能源 知识点题库
A.原料的综合利用 B.开发新能源 C.降低能源消耗 D.废物回收利用
下列项目分别落实了哪项措施,请将该项措施的序号填入括号内:
(1)研制开发耗电量少的节能灯
(2)在海水淡化厂,提取多种物质
(3)垃圾分类回收和建立垃圾发电站
(4)回收废旧电池,进行再利用
(5)种植油料作物,开发生物柴油
(6)提高火电厂原煤的利用率 .
烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 |
燃烧热/(kJ/mol﹣1) | 890 | 1560 | 2220 | 2880 |
据此判断,表示戊烷燃烧的热化学方程式正确的是( )

| 选项 | 古文或古诗词 | 原理 |
| A | 冰,水为之,而寒于水 | 冰变成水过程中ΔH<0,ΔS<0 |
| B | 日照香炉生紫烟 | 紫烟指的是碘的升华 |
| C | 蜡炬成灰泪始干 | 蜡烛燃烧过程中化学能全部转化为光能 |
| D | 《天工开物》记载:“凡白土曰垩土,为陶家精美器用” | 陶瓷是一种传统硅酸盐材料 |
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H1=−71kJ·mol-1
②CO(g)+2H2(g)=CH3OH(l) △H2=−90.5kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H3=−890kJ·mol-1
下列说法正确的是( )
| 燃料 | 一氧化碳 | 甲烷 | 异辛烷(C8H18) | 乙醇 |
| ΔH | -283.0 kJ • mol-1 | -891.0 kJ • mol-1 | -5461.0 kJ • mol-1 | -1366.8 kJ • mol-1 |
使用上述燃料最能体现“低碳经济”理念的是
-
(1) 一个化学反应是释放能量还是吸收能量取决于。已知在25℃、1.013×105Pa下,1mol CH4充分燃烧(C转化为CO2气体,H转化为液态水) 放出的热量为890kJ;使1 kg水的温度升高1℃需热量4.18kJ。则1m3 (标准状况) 甲烷在25℃、1.013×105Pa条件下充分燃烧(生成CO2气体和液态水),释放出的热能是kJ;若用1m3 (标准状况) 甲烷在25℃、1.013×105Pa 条件下充分燃烧所释放的热能加热温度为25℃的水, 若热量损失为20%,可使约kg水沸腾。
-
(2) 现有甲、乙、丙、丁四种金属片,①把甲、乙用导线连接后同时浸入稀硫酸溶液中, 甲上有气泡产生;②把丙、丁用导线连接后同时浸入稀硫酸溶液中,丁发生还原反应;③把甲、丙用导线连接后同时浸入稀硫酸溶液中,电子流动方向为甲→导线→丙。则在①中, 金属片填“甲”、“乙”、“丙”或“丁”,下同)发生氧化反应;在②中,金属片作负极;如果把乙、丁用导线连接后同时浸入稀硫酸溶液, 则金属片上有气泡产生;上述四种金属的活动性顺序是。
-
(3) 某反应的反应物浓度在10min内由10mol/L变成5mol/L,则以该反应物浓度的变化表示的平均反应速率为mol/(L·min);升高温度时,化学反应速率将(填“增大”、“减小”或“不变”);在一定条件下,当可逆反应的正反应速率(填“大于”、“小于”或“等于”)逆反应速率时,该反应就达到了化学平衡状态。
-
(1) 氢气、丙烷是重要的燃料,计算等质量的氢气完全燃烧产生的热量是丙烷完全燃烧产生的热量的倍(精确到小数点后二位)。(已知:氢气、丙烷的燃烧热分别为:286kJ•
 ,2217. 6 kJ•
,2217. 6 kJ•  )
)
-
(2) NH4Al(SO4)2在食品加工中是一种合法的食品添加剂,它还是一种净水剂,其净水的理由是(用化学用语回答)。
-
(3) 龋齿是有机酸使牙齿中的Ca5(PO4)3(OH)溶解造成的。使用含氟牙膏会使其转化为Ca5(PO4)3F抵抗酸的腐蚀,含氟牙膏能使牙断中Ca5(PO4)3(OH)转化为Ca5(PO4)3F的理由足:溶解度Ca5(PO4)3(OH)Ca5(PO4)3F(填“﹥”或“﹤”)。
-
(4) 目前民用电池的主要成分是碱性锌锰电池,该电池的总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2 , 该电池放电时,负极的电极反应式为。
反应1:2CH4(g) C2H2(g)+3H2(g) ΔH1
C2H2(g)+3H2(g) ΔH1
反应2:2CH4(g) C2H4(g)+2H2(g) ΔH2
C2H4(g)+2H2(g) ΔH2
请回答下列问题:
-
(1) 已知几种物质的燃烧热(ΔH)数据如下:
物质
CH4(g)
C2H2(g)
C2H4(g)
H2(g)
燃烧热(ΔH)/(kJ/mol)
-890.3
-1299.5
-1411.0
-285.8
①写出表示C2H2(g)燃烧热的热化学方程式:。
②上述反应中,ΔH1-ΔH2=kJ·mol-1。
③已知反应1的ΔS=+220.2 J·mol-1·K-1 , 则下列所给温度能使该反应自发进行的是(填标号)。
A.0℃ B.25℃ C.1250℃ D.2 000℃
-
(2) 在恒温恒容密闭容器中充入适量CH4发生上述反应1和反应2,下列情况不能说明上述反应达到平衡状态的是____(填字母)。A . 气体总压强不随时间变化 B . 气体密度不随时间变化 C . 气体平均摩尔质量不随时间变化 D . H2体积分数不随时间变化
-
(3) 2CH4(g)
 C2H2(g)+3H2(g)的速率方程为v正=k正c2(CH4),v逆=k逆c(C2H2)·c3(H2)(k正、k逆为正、逆反应速率常数,与温度有关)。其他条件相同,T1℃达到平衡时k正=1.5k逆 , T2℃达到平衡时k正=3. 0k逆。由此推知,T1T2(填“>”“<”或“=”)。
C2H2(g)+3H2(g)的速率方程为v正=k正c2(CH4),v逆=k逆c(C2H2)·c3(H2)(k正、k逆为正、逆反应速率常数,与温度有关)。其他条件相同,T1℃达到平衡时k正=1.5k逆 , T2℃达到平衡时k正=3. 0k逆。由此推知,T1T2(填“>”“<”或“=”)。
-
(4) 一定温度下,在总压强保持恒定为121 kPa时,向某密闭容器中充入CH4和N2组成的混合气体( N2不参与反应),测得CH4的平衡转化率与通入气体中CH4的物质的量分数的关系如图所示。
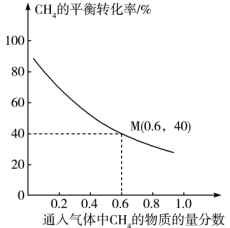
①图中随着通入气体中CH4的物质的量分数的增大,甲烷的平衡转化率降低的主要原因是。
②已知M点乙炔的选择性为75% [乙炔的选择性=
 ×100%]。该温度下,反应2的平衡常数Kp=kPa(结果保留2位有效数字,Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
×100%]。该温度下,反应2的平衡常数Kp=kPa(结果保留2位有效数字,Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
①通过植树造林捕捉二氧化碳②禁止使用煤和石油等化石能源③大力发展风能、太阳能等新型能源④工业中用碱石灰吸收 ⑤绿色出行,减少燃油车的使用
⑤绿色出行,减少燃油车的使用
-
(1) 已知:I.H2O(g) = H2(g) +
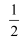 O2(g) ΔH = +241.8kJ/mol
O2(g) ΔH = +241.8kJ/molII.C(s) +
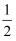 O2(g) = CO(g) ΔH = -110.5kJ/mol
O2(g) = CO(g) ΔH = -110.5kJ/molIII.C(s) + O2(g) = CO2(g) ΔH = -393.5kJ/mol
①上述反应中,属于吸热反应的是(填序号)。
②表示C的燃烧热的热化学方程式为(填序号)。
③写出CO燃烧的热化学方程式。
-
(2) 在密闭容器中,通入a mol N2和b mol H2 , 在一定条件下反应达到平衡时,容器中剩余c mol N2。
①达到平衡时,生成NH3的物质的量为,H2的转化率为。
②若把容器的容积缩小一半,则正反应速率(填“增大”“减小”或“不变”,下同),逆反应速率,N2的转化率。



