第二节 燃烧热 能源 知识点题库
化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等.
(1)下列△H表示物质标准燃烧热的是 ;表示中和反应反应热的是 .(填“△H1”、“△H2”、“△H3”等)
A.2H2(g)+O2(g)═2H2O(l)△H1B.C(s)+ O2(g)═CO(g)△H2=﹣Q1kJ•mol﹣1
O2(g)═CO(g)△H2=﹣Q1kJ•mol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3D.C(s)+O2(g)═CO2(g)△H4=﹣Q2kJ•mol﹣1
E.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H5
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应的热化学方程式: .
(3)根据题(1)中B、D判断1molCO(g)完全燃烧的△H= .
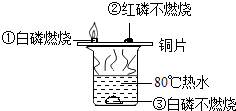
(4)反应E的△H6可以用如图所示的装置进行测量.实验中直接测定的数据是 ;从实验装置上看,图中尚缺少的一种玻璃用品是 ;大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值 (填“偏大”“偏小”或“无影响”).

(1) ;(2) ;(3)
(1)已知某固体推进剂主要由可燃剂(聚丁二烯等)和氧化剂甲(一种由三种元素组成的盐)组成,则甲的化学式为 ,并用离子方程式表示甲的水溶液呈酸性的原因 .
(2)已知某液体推进剂主要由可燃剂乙和氧化剂丙组成,乙和丙常温下呈液态,它们均为氢化物(氢与其他元素形成的二元化合物)且分子中含有相同的电子数,常温下,乙和丙可生成一种常见的液态化合物和一种常见的稳定单质,试写出该反应的化学方程式 另一种气态无色的氧化剂丁升温时(隔绝空气)迅速转化为红棕色气体,1mol乙在常温下与丁完全反应可放出Q kJ热量,产物与丙完全相同,试写出该反应的热化学方程式 .
(3)根据上述原理,以下物质中不可能作为推进剂的是
A.石油产品 B.尿素 C.液氟 D.高氯酸铵
(4)戊也可作液体推进剂的氧化剂,取19.6g化合物戊,隔绝空气加热使其完全分解,生成氮气、氧气和二氧化碳,生成的氮气折合成标准状况下的体积为4.48L,生成的二氧化碳气体被足量的澄清石灰水吸收,得到10.0g沉淀,则戊的化学式为
(5)请您设计一个实验方案,探究由上述四种元素组成的常见无机盐可能的成分.
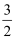 O2(g)=P2O3(s)△H=﹣(40Y﹣2X)kJ•mol﹣1
D . 生成的 P2O3与 P2O5的质量之比为 1:1
O2(g)=P2O3(s)△H=﹣(40Y﹣2X)kJ•mol﹣1
D . 生成的 P2O3与 P2O5的质量之比为 1:1
①可砍伐树木、野草作能源
②可用酒精作能源
③可利用电解水的方法制得氢气作能源
④应开发太阳能、核能等新能源
⑤大量应用风能、水能等可再生能源.
 O2(g)═CO(g)△H=110.5 kJ•mol﹣1
B . C(s)+O2(g)═CO2(g)△H=﹣393.5 kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ•mol﹣1
D . H2(g)+
O2(g)═CO(g)△H=110.5 kJ•mol﹣1
B . C(s)+O2(g)═CO2(g)△H=﹣393.5 kJ•mol﹣1
C . 2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ•mol﹣1
D . H2(g)+  O2(g)═H2O(g)△H=﹣241.8 kJ•mol﹣1
O2(g)═H2O(g)△H=﹣241.8 kJ•mol﹣1
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物能 ⑦风能 ⑧氢能.
①化学反应除了生成新物质外,还伴随着能量的变化;②同温同压下,H2 (g)+Cl2 (g)==2HCl(g)在光照和点燃条件下的反应热ΔH不同;③为防治酸雨、降低工业废气,常用生石灰进行“钙基固硫”:CaO+SO2= CaSO3、2CaSO3+O2=2CaSO3;④开发太阳能、风能、地热能、潮汐能等新能源,可减少雾霾、保护环境;⑤煤的气化和液化技术,可高效、清洁地利用煤;⑥从海水提镁的过程为:MgCl2(aq) 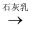 Mg(OH)2
Mg(OH)2  MgO
MgO  Mg
Mg
-
(1) 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生,下列属于未来新能源标准的是______(填字母)。
①石油②煤③天然气④沼气⑤太阳能⑥氢能⑦风能
A . ③④⑤ B . ③⑤⑥⑦ C . ③⑤⑥ D . ④⑤⑥⑦ -
(2) 25℃、101Pa时,11g丙烷C3H8完全燃烧生成CO2和液态水时放出的热量是555.0kJ,则表示丙烷燃烧热的热化学方程式是。
-
(3) 运动会上使用的火炬的燃料一般是丙烷(C3H8),丙烷在一定条件下发生脱氢反应可以得到丙烯。已知:C3H8(g)→CH4(g)+HC
 CH(g)+H2(g)△H=+156.6kJ/mol
CH(g)+H2(g)△H=+156.6kJ/mol CH3CH=CH2(g)→CH4(g)+HC
 CH(g)△H=+32.4kJ/mol
CH(g)△H=+32.4kJ/mol则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=kJ/mol。
-
(4) 某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是,烧杯间填满碎塑料泡沫的作用是。
②大烧杯上如不盖硬纸板,则求得的中和热数值(填“偏大”“偏小”“无影响”)。
③实验中改用20mL0.5mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”);所求中和热的数值会 (填“相等”或“不相等”)。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能




根据以上热化学方程式,判断下列说法正确的是( )

 C . CO与
C . CO与 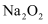 反应放出509kJ热量时,电子转移数一定是
反应放出509kJ热量时,电子转移数一定是  D . CO的燃烧热为-283kJ
D . CO的燃烧热为-283kJ
 2NH3(g) △H= -38.6 kJ·mol-1
2NH3(g) △H= -38.6 kJ·mol-1



