第二节 燃烧热 能源 知识点题库
①H2(g)+  O2(g)═H2O(l)△H=﹣285.8kJ/mol
O2(g)═H2O(l)△H=﹣285.8kJ/mol
②H2(g)+  O2(g)═H2O(g)△H=﹣241.8kJ/mol
O2(g)═H2O(g)△H=﹣241.8kJ/mol
③C(s)+  O2(g)═CO(g)△H=﹣110.5kJ/mol
O2(g)═CO(g)△H=﹣110.5kJ/mol
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
回答下列各问题:
-
(1) 上述反应中属于放热反应的是 .
-
(2) H2的燃烧热为;C的燃烧热为 .
-
(3) 燃烧10g H2生成液态水,放出的热量为 .
-
(4) CO的燃烧热为;其热化学方程式为.
①H2(g)+ O2(g)═H2O(l)△H=﹣285.8kJ/mol
O2(g)═H2O(l)△H=﹣285.8kJ/mol
②H2(g)+ O2(g)═H2O(g)△H=﹣241.8kJ/mol
O2(g)═H2O(g)△H=﹣241.8kJ/mol
③C(s)+ O2(g)═CO(g)△H=﹣110.5kJ/mol
O2(g)═CO(g)△H=﹣110.5kJ/mol
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
回答下列各问题:
-
(1) 上述反应中属于放热反应的是
-
(2) H2的燃烧热为 ;C的燃烧热为
-
(3) 燃烧10g H2生成液态水,放出的热量为
-
(4) CO的燃烧热为 ;其热化学方程式为
物质 | 炭粉 | 一氧化碳 | 氢气 | 甲烷 | 乙醇 |
状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
-
(1) 从热量角度分析,目前最适合家庭使用的优质气体燃料是.
-
(2) 写出乙醇完全燃烧的热化学方程式.
物质 | 氢气 | 原煤 (主要成分是C) | 汽油 (主要成分C8H18) |
热量(kJ) | 285.8 | 250.9 | 4910 |
-
(1) H2燃烧的热化学方程式是.
-
(2) 工业上电解饱和盐水的副产物之一是H2 , 反应的离子方程式是.
-
(1) 25℃ 1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量
-
(2) 当10g丁烷完全燃烧生成CO2和液态水时,放出热量为500kJ,写出丁烷燃烧的热化学方程式:
-
(3) 1mol C与1mol水蒸气反应生成1mol CO和1mol H2 , 吸热131.5kJ: 。
-
(4) 3 molNO2气体溶于水生成HNO3和NO气体,放出138kJ热量
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
-
(1) 甲醇蒸气完全燃烧的热化学方程式为。
-
(2) 反应②中的能量变化如图
 ,
,
该反应为(吸或放)热反应,ΔH2=。(用E1、E2表示)
-
(3) H2(g)的燃烧热为。
Sabatier 反应:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
水电解反应:2H2O(l)  2H2(g)+O2(g)
2H2(g)+O2(g)
-
(1) 将原料气按 n(CO2)∶ n(H2)=1∶4 置于密闭容器中发生 Sabatier 反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

①该反应的平衡常数 K 随温度升高而(填“增大”或“减小”)。
②温度过高或过低均不利于该反应的进行,原因是。
③下列措施能提高 CO2 转化效率的是(填标号)。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中 CO2 所占比例
E. 合理控制反应器中气体的流速
-
(2) 将一定量的 CO2(g)和 CH4(g)通入一恒容密闭容器中发生反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g) Δ H =+248 kJ·mol-1。
为了探究该反应的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2 与CH4 ,使其物质的量浓度均为1.0mol·L-1 , 平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图, v正~ c(CH4)和 v逆 ~ c(CO)。则与 v正~ c (CH4)相对应曲线是图中(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为(填“D”“E”或“F”)。

-
(3) 用稀氨水喷雾捕集 CO2最终可得产品NH4HCO3。在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s) ⇌2NH3(g)+CO2 (g)。实验测得的有关数据见下表( t1 < t2 < t3 )

氨基甲酸铵分解反应是(填“放热”或“吸热”)反应。15℃时此反应的化学平衡常数 K =。
-
(4) 一种新的循环利用方案是用 Bosch 反应 CO2(g)+2H2(g) ⇌C(s)+2H2O(g)代替 Sabatier 反应。
① 已知 CO2(g)、H2O(g)的生成焓分别为–394 kJ∙mol-1 、–242 kJ∙mol-1 , Bosch 反应的Δ H =kJ∙mol-1(生成焓指一定条件下由对应单质生成 1mol 化合物时的反应热)。
②一定条件下 Bosch 反应必须在高温下才能启动,原因是。
③该新方案的优点是。
| 化合物 | 燃烧热(kJ·mol-1) | 化合物 | 燃烧热(kJ·mol-1) |
| 甲烷 | 890.3 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2-甲基丁烷 | 3 531.3 |
下列说法正确的是( )
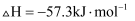 ,则
,则  和
和 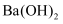 反应的中和热
反应的中和热 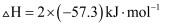 B .
B . 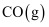 的燃烧热是
的燃烧热是 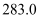
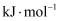 ,则
,则 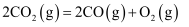 反应的
反应的 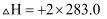
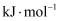 C . 需要加热才能发生的反应一定是吸热反应
D . 乙烷的燃烧热就是1mol乙烷燃烧生成气态水和二氧化碳所放出的热量
C . 需要加热才能发生的反应一定是吸热反应
D . 乙烷的燃烧热就是1mol乙烷燃烧生成气态水和二氧化碳所放出的热量
 O2(g)=CO(g) ΔH2 , 则ΔH2<ΔH1
C . 已知2H2(g)+O2(g)=2H2O(g) ΔH =-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D . 已知稀的强酸和强碱的中和热为57.3 kJ/mol,则表示稀硫酸和氢氧化钠中和热的热反应方程式为
O2(g)=CO(g) ΔH2 , 则ΔH2<ΔH1
C . 已知2H2(g)+O2(g)=2H2O(g) ΔH =-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D . 已知稀的强酸和强碱的中和热为57.3 kJ/mol,则表示稀硫酸和氢氧化钠中和热的热反应方程式为  H2SO 4+NaOH=
H2SO 4+NaOH=  Na2SO4 +H2O ΔH=-57.3 kJ/mol
Na2SO4 +H2O ΔH=-57.3 kJ/mol
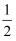 O2(g)
O2(g) H2O(l) ΔH=285.8kJ·mol-1
D . “冰,水为之,而寒于水”说明相同质量的水和冰相比较,水的能量高
H2O(l) ΔH=285.8kJ·mol-1
D . “冰,水为之,而寒于水”说明相同质量的水和冰相比较,水的能量高



