第二节 燃烧热 能源 知识点题库
已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g);△H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是
A . 浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
B . 若碳的燃烧热用△H3来表示,则△H3<△H1
C . 若碳的燃烧热用△H3来表示,则△H3>△H1
D . 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
天然气和液化石油气(主要成分为C3~C8的烷烃)燃烧的化学方程式分别是:CH4+2O2 CO2+2H2O,C3H8+5O2
CO2+2H2O,C3H8+5O2 3CO2+4H2O.现有一套以天然气为燃料的灶具,欲改烧液化石油气,应采用的正确措施是( )
3CO2+4H2O.现有一套以天然气为燃料的灶具,欲改烧液化石油气,应采用的正确措施是( )
A . 减小空气进入量,减小石油气进入量
B . 增大空气进入量或减小石油气进入量
C . 增大空气进入量,增大石油气进入量
D . 减小空气进入量或增大石油气进入量
能源可划分为一级能源和二级能源,自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取;未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列叙述正确的是( )
A . 水煤气,电能是一级能源
B . 天然气,水力是二级能源
C . 核能,煤,石油符合未来新能源标准
D . 太阳能,生物质能,风能,氢能符合未来新能源标准
山西是我国重要的能源、化工基地,也是卫星发射基地.请回答下列问题.
-
(1) 目前我省居民使用的主要能源有①煤②石油③风能④天然气⑤电能等,其中属于可再生能源的是(填序号),请再举出我省居民生活中的一种可再生能源.
-
(2) 天然气不仅可以用来直接燃烧提供能量,还是重要的化工原料.天然气的主要成分是,它可以与水在高温条件下反应制得水煤气(CO和H2),反应的化学方程式是,此时得到的水煤气中 CO和 H2的质量比是.
-
(3) 火箭可将卫星送入太空.火箭推进器中的强还原剂液态肼(N2H4)和强氧化剂混合时,发生反应 N2H4+2X═N2+4H2O,瞬间产生大量气体,推动火箭前进.由此判断X的化学式是,该反应为放热反应,反应物的总能量生成物总能量(填“高于”、“低于”或“等于”).
-
(1) 现有 CH4、C2H4、C3H4、C2H6、C3H6 五种有机物。同质量的以上物质完全燃烧时消耗 O2的量最多的是;同状况、同体积的以上五种物质完全燃烧时消耗 O2的量最多的是;同质量的以上五种物质燃烧时,生成 CO2 的量最多的, 生成 H2O的量最多的是。
-
(2) 以乙烯和水为主要原料选取其他必要的无机物制取乙酸乙酯,写出对应的化学方程式
已知:乙醛可氧化为乙酸(该方程式不用写)
在下列各说法中,正确的是( )
A . ΔH>0表示放热反应
B . 1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
C . 1mol H2SO4与1mol Ba(OH)2完全反应放出的热叫做中和热
D . 热化学方程式中的化学计量数表示物质的量,可以用分数表示
下列说法不正确的是( )
A . 干冰可用于人工降雨
B . 氢气的热值比天然气的低
C . 硫酸铜可用作游泳池消毒
D . 氢氧化铁胶体能用于净水
下列有关能源的理解或说法错误的是( )
A . 煤、石油、太阳能、风能等均属于新能源
B . 乙醇是一种可再生能源,可代替汽油作为汽车燃料
C . 氢气是最轻的燃料,是具有广阔发展前景的能源
D . 研发开采可燃冰水合甲烷的技术,可大大缓解能源危机
-
(1) 一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)
 CO2(g) + 3H2(g)
CO2(g) + 3H2(g)  H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则 ①达平衡时混合气体的压强是反应前的倍。
②该条件下反应达平衡状态的依据是(填序号)。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
-
(2) 在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为。
25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1 , 辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是( )
A . 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
B . KOH(aq)+  H2SO4(aq)=
H2SO4(aq)=  K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C . C8H18(l)+
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C . C8H18(l)+ 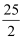 O2(g)=8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D . 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)=8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D . 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
 H2SO4(aq)=
H2SO4(aq)=  K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C . C8H18(l)+
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C . C8H18(l)+ 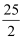 O2(g)=8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D . 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)=8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D . 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
已知石墨的燃烧热为△H1 , 金刚石的燃烧热为△H2 , 下列说法正确的是( )
A . 由于燃烧均为放热反应,所以石墨为重要的能源
B . 由于燃烧反应放热,所以△H1和△H2均取正值
C . 由于石墨和金刚石同为碳元素组成,所以△H1=△H2
D . 由于石墨和金刚石属于不同的单质,所以△H1和△H2不等
下列说法不正确的是( )
A . 光催化还原水制氢比电解水制氢更节能环保、更经济
B . 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
C . 某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol·L-1的目标分子
D . 向汽油中添加甲醇后,该混合燃料的热值不变
下列说法正确的是( )
A . 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B . 热化学方程式C2H2(g)+ 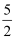 O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1 , 可知乙炔的燃烧热为1256kJ·mol-1
C . 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1
D . 稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 , 若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3 kJ
O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1 , 可知乙炔的燃烧热为1256kJ·mol-1
C . 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1
D . 稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 , 若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3 kJ
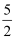 O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1 , 可知乙炔的燃烧热为1256kJ·mol-1
C . 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1
D . 稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 , 若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3 kJ
O2(g)=2CO2(g)+H2O(g) ΔH=-1256kJ·mol-1 , 可知乙炔的燃烧热为1256kJ·mol-1
C . 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1
D . 稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 , 若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于57.3 kJ
陕西省将于2021年承办中华人民共和国第十四届运动会。下列措施不利于节能减排、改善环境质量的是( )
A . 利用太阳能等清洁能源代替化石燃料
B . 引进电动汽车,减少汽车尾气排放
C . 积极推行和使用能被微生物降解的新型聚合物材料
D . 使用填埋法处理未经分类的生活垃圾
化学与生活密切相关。下列说法错误的是( )
A . 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
B . 绿色化学要求从源头上消除或减少生产活动对环境的污染
C . PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
D . 天然气和液化石油气是我国目前推广使用的清洁燃料
依据事实,回答下列问题。
-
(1) 在25℃、101kPa时,1.0gC8H18(l,辛烷)燃烧生成CO2(g)和H2O(l),放出48.40kJ的热量,则C8H18(l)的燃烧热为kJ/mol。
-
(2) 已知N2(g)+2O2(g)=2NO2(g);ΔH=+67.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH=-534kJ/mol,根据盖斯定律写出肼(N2H4)与NO2完全反应生成氮气和气态水的热化学方程式。
-
(3) 某反应过程中的能量变化如图所示,则该反应是(填“放热”或“吸热”)反应,判断依据是。

-
(4) 已知:2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462kJ•mol-1
 ,
, 
则断开1molH–N键与断开1molH–Cl键所需能量相差约为kJ。
我国在探索太空、开发深海、建设高铁、5G 技术联通等方面取得举世瞩目的成就,这些成就与化学有着密切联系。下列说法正确的是( )
A . 长征五号运载火箭箭体采用铝合金是为了美观耐用
B . 大力发展太阳能、风能、氢能等新能源有利于生态文明建设
C . 网络强国战略铺设光缆线路超三千万公里,光缆的主要成分是晶体硅
D . 5G 手机电池工作时,电池中化学能完全转化为电能
下列说法中正确的是( )
A . 化石燃料在任何条件下都能充分燃烧
B . 化石燃料在燃烧过程中会产生污染环境的有害气体如CO、SO2等
C . 直接燃烧煤和将煤深加工后再燃烧的热效率相同
D . 固体煤变为气体燃料后,燃烧效率将降低
一团棉花包裹少量过氧化钠放在石棉网上,将CO2气体缓缓通入棉花中的过氧化钠 上,棉花很快燃烧起来,根据实验分析可知,下列表达错误的是( )
A . CO2对棉花起助燃作用
B . 过氧化钠与CO2反应放热
C . 反应生成的O2有利于棉花燃烧
D . 过氧化钠与CO2反应固体质量增加了
中国向世界庄严宣布:二氧化碳排放力争在2030年前达到峰值、在2060年前达到碳中和。下列措施不能减少碳排放的是:( )
A . 推广“液态阳光”技术,促使CO2加氢转化为液态燃料
B . 在汽车排气管里安装催化转化装置,将CO与氮氧化物转化为CO2、N2等排入空气
C . 倡导低碳生活,注意节约用电
D . 利用风能、水能等可再生能源发电替代火力发电
最近更新



