第二节 燃烧热 能源 知识点题库
关于用水制取二级能源氢气,以下研究方向不正确的是( )
A . 构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B . 设法将太阳光聚集,产生高温,使水分解产生氢气
C . 寻找高效催化剂,使水分解产生氢气,同时释放能量
D . 寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
下列说法正确的是( )
A . 将废电池深埋,可防止重金属污染
B . 所有需要加热的化学反应都是吸热反应
C . 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境
D . 开发利用可燃冰是缓解能源紧缺的唯一途径
下列措施不符合节能减排的是( )
A . 在屋顶安装太阳能热水器为居民提供生活用水
B . 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
C . 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气作为家庭燃气
D . 大力发展火力发电,解决广东电力紧张问题
在下列能源的利用过程中,不直接产生CO2的有( )
A . 石油
B . 太阳能
C . 氢能
D . 天然气
下列有关化学反应的描述中正确的是( )
A . HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
B . CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol
C . 甲烷的燃烧热△H=﹣890.3kJ•mol﹣1 , 则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ•mol﹣1
D . Mg在CO2中燃烧生成MgO和C,该反应中化学能全部转化为热能
下列能源符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A . ①②③④
B . ⑤⑥⑦⑧
C . ④⑤⑥⑦⑧
D . ③④⑤⑥⑦⑧
下列关于能源的说法不正确的是( )
A . 物质的化学能可在不同条件下转变成热能、电能为人类所使用
B . 太阳能能直接转化为化学能
C . 全面推广利用氢能,禁止在任何条件下利用任何化石燃料
D . 在西部和沿海地区兴建风力发电站,解决能源问题
下列关于热化学反应的描述中正确的是( )
A . HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1
B . CO(g)的燃烧热是283.0kJ·mol-1 , 则2CO2(g)=2CO(g)+O2(g)的ΔH=2×(+283.0) kJ·mol-1
C . 需要加热才能发生的反应一定是吸热反应
D . 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
在下列各说法中,正确的是( )
A . 需要加热才能发生的反应一定是吸热反应
B . 热化学方程式中的化学计量数只表示物质的量,可以是分数
C . 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D . 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
下列说法正确的是( )
A . 在101kPa时,1molC与适量O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol
B . 在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为-285.8kJ/mol
C . 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
D . 在稀溶液中:H+(aq) + OH-(aq) = H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
下列各项中正确的是( )
A . 已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ·mol-1 , 则H2SO4和Ba(OH)2反应的反应热 ΔH=2×(-57.3) kJ·mol-1
B . 已知CH3OH(g)+1/2O2(g) = CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1 , 则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C . H2(g)的燃烧热是285.8 kJ·mol-1 , 则2H2O(g) = 2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D . 葡萄糖的燃烧热是2800 kJ·mol-1 , 则1/2C6H12O6(s)+3O2(g) = 3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1
下列有关热化学反应的描述中正确的是( )
A . HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 ΔH=2×(-57.3)kJ/mol
B . CO(g)的燃烧热是-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=(2×283.0)kJ/mol
C . 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D . 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:;若1g水蒸气转化为液态水放热2.444kJ,则反应H2(g)+1/2O2(g)=H2O(l)的ΔH=kJ/mol 。氢气的燃烧热为kJ/mol。
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
A . C(s)+ 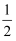 O2(g)=CO(g) ΔH=-393.5kJ/mol
B . 2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C . CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol
B . 2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C . CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
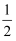 O2(g)=CO(g) ΔH=-393.5kJ/mol
B . 2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C . CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol
B . 2H2(g)+O2(g)=2H2O(l) ΔH =+571.6kJ/mol
C . CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D . C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH=-2800kJ/mol
下列反应的反应热属于燃烧热的是( )
A . Na(s)+  Cl2(g)=NaCl(s)△H1
B . 2Na(s)+
Cl2(g)=NaCl(s)△H1
B . 2Na(s)+  O2(g)=Na2O(s)△H2
C . 2Na(s)+O2(g)=Na2O2(s)△H3
D . CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H4(已知CH3OCH3沸点为-24.9℃)
O2(g)=Na2O(s)△H2
C . 2Na(s)+O2(g)=Na2O2(s)△H3
D . CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H4(已知CH3OCH3沸点为-24.9℃)
 Cl2(g)=NaCl(s)△H1
B . 2Na(s)+
Cl2(g)=NaCl(s)△H1
B . 2Na(s)+  O2(g)=Na2O(s)△H2
C . 2Na(s)+O2(g)=Na2O2(s)△H3
D . CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H4(已知CH3OCH3沸点为-24.9℃)
O2(g)=Na2O(s)△H2
C . 2Na(s)+O2(g)=Na2O2(s)△H3
D . CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H4(已知CH3OCH3沸点为-24.9℃)
下列说法正确的是( )
A . 石油和煤是可再生资源
B . 乙烯的产量是衡量一个国家石油化工发展水平的标志
C . 油脂在酸性条件下水解可制得肥皂
D . 蛋白质、淀粉、油脂是天然高分子化合物
可再生能源和清洁能源将成为新能源的主力军,下列关于能源的叙述正确的是( )
A . 化石燃料是可再生能源
B . 氢能、太阳能是清洁能源
C . 化石燃料都是清洁能源
D . 海洋能、地热能是不可再生的清洁能源
氢燃料电池汽车每投放100万辆,一年可减少二氧化碳排放5.1亿吨,这将极大助力碳中和目标实现。下列有关氢燃料电池说法错误的是( )
A . 发展氢燃料电池汽车需要安全高效的储氢技术
B . 理论上氢燃料电池汽车使用时不会产生污染物
C . 氢燃料电池汽车直接将化学能转化为动能
D . 氢燃料电池汽车运行不排放二氧化碳
已知下列热化学方程式:
①H2(g)+  O2(g)═H2O(l) △H=﹣285.8kJ•mol﹣1
O2(g)═H2O(l) △H=﹣285.8kJ•mol﹣1
②H2(g)+  O2(g)═H2O(g) △H=﹣241.8kJ•mol﹣1
O2(g)═H2O(g) △H=﹣241.8kJ•mol﹣1
③C(s)+  O2(g)═CO(g) △H=﹣110.5kJ•mol﹣1
O2(g)═CO(g) △H=﹣110.5kJ•mol﹣1
④CO2(g)═C(s)+O2(g) △H=+393.5kJ•mol﹣1
回答下列各问题:
-
(1) 上述反应中属于放热反应的是。
-
(2) H2的燃烧热为;C的燃烧热为。
-
(3) 燃烧10gH2生成液态水,放出的热量为。
-
(4) CO燃烧热的热化学方程式为。
下列说法不正确的是( )
A . 煤的干馏是化学变化
B . 煤液化后可以得到甲醇等液体燃料
C . 煤经气化和液化两个物理变化过程,可变为清洁能源
D . 根据煤的干馏产品,可推知煤中含有C、H、O、N等元素
最近更新



