第一节 原电池 知识点题库


-
(1) 锌为:极(填“正”或“负”)电极反应式为:,
-
(2) 反应过程中电流的方向为:
A 由铜流向锌 B 由锌流向铜
-
(3) 若有锌片质量减少了0.65g,则转移了 mol电子发生转移,铜片上产生气体的体积(标况下)为: L.

Date:2015.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Zn极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥正极的电极反应式:Zn﹣2e﹣=Zn2+ |
-
(1) 在卡片上,叙述合理的是(填序号).
-
(2) 在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是.
-
(3) 如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因.
-
(4) 如果把硫酸换成硫酸铜溶液,猜测(填“锌极”或“铜极”)变粗,原因是(用电极方程式表示).




-
(1) 铝为极,KNO3盐桥中的离子进入a烧杯中,银器的电极反应式为。
-
(2) 如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,阳极的电极反应式是,总反应的化学方程式是。
 ,下列关于该电池工作时的说法正确的是( )
,下列关于该电池工作时的说法正确的是( ) 
 C . 甲池和乙池中的溶液的pH均减小
D . 当甲池中消耗
C . 甲池和乙池中的溶液的pH均减小
D . 当甲池中消耗  时,乙池中理论上最多产生6.4g固体
时,乙池中理论上最多产生6.4g固体
-
(1) 已知:N2 (g) +O2 (g) =2NO (g) △H=+180.5kJ·mol-1
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为:K=
 ,请写出此反应的热化学方程式,该反应(填高温、低温)能自发进行。
,请写出此反应的热化学方程式,该反应(填高温、低温)能自发进行。 -
(2) 在密闭容器中充入5molCO和4molNO,发生上述(1)中某反应,如图为平衡时NO的体积分数与温度、压强的关系。回答下列问题:

①温度:T1T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=L/mol(保留两位有效数字);用CO的浓度变化表示的平均反应速率(CO)=。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的点。
-
(3) N2O5在一定条件下可发生分解:2N2O5
 4NO2(g)+O2(g),一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是(填字母)。
4NO2(g)+O2(g),一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是(填字母)。 a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2V正(NO2)=V逆(N2O5) d.气体的密度保持不变
-
(4) 用CH4催化还原NOx可以消除污染,若将反应CH4+2NO2=CO2+2H2O+N2设计为原电池,电池内部是掺杂氧化钇的氧化锆晶体,可以传导O2- , 则电池的正极反应式为。

 )废水的装置如下图所示。下列说法正确的是( )
)废水的装置如下图所示。下列说法正确的是( ) 


 离子在铁的表面被还原
C . 金属的腐蚀速率由慢到快的顺序是:
离子在铁的表面被还原
C . 金属的腐蚀速率由慢到快的顺序是:  D . 一段时间后,两烧杯中溶液的
D . 一段时间后,两烧杯中溶液的  均增大
均增大
| 实验操作和现象 | 实验结论 | |
| A | 向某溶液先滴加 | 原溶液中一定有 |
| B | 向 | |
| C | 向某溶液加入氢氧化钠溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝。 | 原溶液中一定无 |
| D | 将相同大小的铜片和锌片插入苹果中,用导线在铜片和锌片之间串联一个电流表,发现电流表的指针发生偏转。 | 水果电池产生的电流从锌片沿导线流向铜片 |
-
(1) 电解NaHSO3溶液制备Na2S2O4 , 装置如图所示。
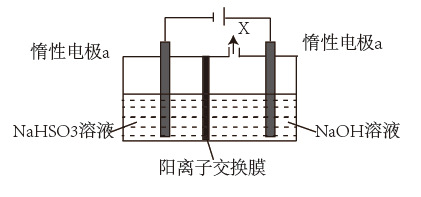
①X为(填化学式)。
②电极a的电极反应式为。
③装置若无阳离子交换膜(填“能”或“不能”)得到Na2S2O4。
-
(2) 锌粉法制备Na2S2O4 , 装置(部分夹持仪器已省略)如图所示。
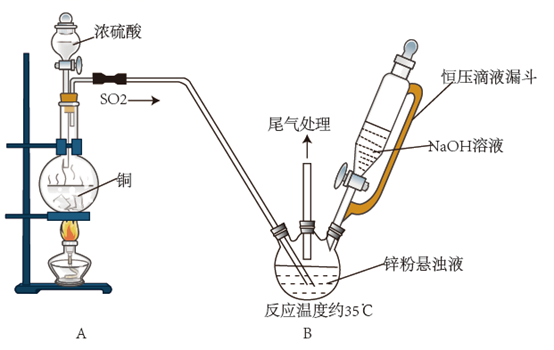
①盛放浓硫酸的仪器名称为;写出装置A烧瓶内反应的化学方程式:。
②通入SO2前装置B的三颈烧瓶内应先通入N2 , 目的是。通入SO2 , 控制反应温度约为35℃,反应一段时间后再滴加NaOH溶液将有Na2S2O4和Zn(OH)2生成。控制反应温度约为35℃的方法是,写出生成Na2S2O4和Zn(OH)2总反应离子方程式:。
③将反应后的悬浊液过滤后在微热下加入氯化钠冷却至20℃,析出Na2S2O4结晶过滤后,再用乙醇洗涤几次后,置于真空干燥箱中干燥即得到Na2S2O4。简述用乙醇洗涤的原因:。
-
(3) 产品中Na2S2O4纯度的测定。
称取mgNa2S2O4样品溶于冷水中配成100mL溶液,取出10mL该溶液置于预先盛有20mL中性甲醛溶液的烧杯中,搅拌至完全溶解,转移至250mL容量瓶中用水稀释至刻度摇匀。移取25mL该溶液于250mL锥形瓶中加入4mL盐酸溶液,用cmol·L-1的碘标准溶液滴定,近终点时加入3mL淀粉溶液继续滴定,至溶液呈浅蓝色在30s内颜色不消失,用去碘标准溶液VmL。产品中Na2S2O4的质量分数为。
已知:Na2S2O4+2CH2O+H2O=NaHSO3∙CH2O+NaHSO2∙CH2O
NaHSO2∙CH2O+2I2+2H2O=NaHSO4+CH2O+4HI
 ②电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列关于电池的叙述正确的是( )
②电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列关于电池的叙述正确的是( )

 燃料电池(
燃料电池(  )是一种新型液态电池,其工作原理如图所示。下列说法错误的是( )
)是一种新型液态电池,其工作原理如图所示。下列说法错误的是( ) 
 B . 负极区溶液
B . 负极区溶液  增大
C . “电极b”的反应式为
增大
C . “电极b”的反应式为  D . 当电路中转移
D . 当电路中转移  电子时,通过阴离子交换膜的
电子时,通过阴离子交换膜的  为4.8g
为4.8g
 CO2 △H已知反应中化学键数据如下表:
CO2 △H已知反应中化学键数据如下表:化学键 | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | 436 | 351 | 745 | 463 | 413 |
回答下列问题:
-
(1) △H(填“>”“<”或“=”)0。
-
(2) 某温度下,向该容器中充入0.3molCO2、0.9molH2 , 发生上述反应,5min末,反应达到平衡,此时测得H2O(g)的物质的量分数为25%。
①0~5min内,
 平均速率v(
平均速率v( )=
)= 。
。②每生成
 , 转移的电子数为
, 转移的电子数为 。
。③反应前后的总压强之比为。
-
(3) 有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是
 ,
,  可以在其中自由移动。电极a的反应式为:
可以在其中自由移动。电极a的反应式为:
 溶液有白色沉淀生成,再加稀硝酸,沉淀不溶解。
溶液有白色沉淀生成,再加稀硝酸,沉淀不溶解。
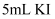 溶液中滴加5-6滴相同浓度
溶液中滴加5-6滴相同浓度  溶液,充分反应后滴入
溶液,充分反应后滴入 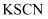 溶液,溶液变血红色。
溶液,溶液变血红色。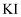 与
与 



