第一节 原电池 知识点题库
某原电池结构如图所示,下列有关该原电池的说法正确的是( )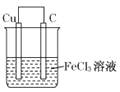
②瑞典ASES公司设计的曾用于驱动潜艇的液氨﹣液氧燃料电池如图所示,该燃料电池工作时,负极的电极反应式为;电池的总反应为.

-
(1) 铁棒上,
-
(2) 碳棒上,
-
(3) 溶液里。
-
(1) 重铬酸钾(K2Cr2O7)主要用于制革、印染、电镀等.其水溶液中存在平衡:Cr2O72﹣+H2O
 2CrO42﹣+2H+。以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图
2CrO42﹣+2H+。以铬酸钾(K2CrO4)为原料,用电化学法制备重铬酸钾的实验装置如图 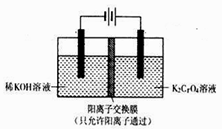
①写出阴极区的电极反应式,透过离子交换膜的离子是,移动方向为(填“由左向右”或“由右向左)。
②阳极区能得到重铬酸钾溶液的原因为。
-
(2) 工业上采用下面的方法处理含有Cr2O72-的酸性工业废水:废水中加入适量NaCl,以铁为电极进行电解,有Cr(OH)3和Fe(OH)3沉淀生成,关于上述方法,下列说法正确的是(填字母序号)。
A.阴极反应:2H++2e-=H2↑
B.阳极反应:Fe-3e-=Fe3+
C.在电解过程中当电路转移0.6mol电子时,被还原的Cr2O72-为0.05mol
D.可以将铁电极改为石墨电极
反应I
C4H10(g)  CH4(g)+CH3CH-CH3(g) △H1;
CH4(g)+CH3CH-CH3(g) △H1;
反应Ⅱ C4H10(g)  C2H6(g)+CH2=CH2(g) △H2;
C2H6(g)+CH2=CH2(g) △H2;
回答下列问题:
-
(1) 正丁烷、乙烷和乙烯的燃烧热分别为Q1kJ·mol-1、Q2kJ·mol-1、Q3kJ·mol-1 , 反应Ⅱ的△H2=。
-
(2) 一定温度下,向容积为5L的密闭容器中通入正丁烷,反应时间(t)与容器内气体总压强(p)数据如下:
t/min
0
a
2a
3a
4a
p/MPa
5
7.2
8.4
8.8
8.8
①该温度下,正丁烷的平衡转化率a=;反应速率可以用单位时间内分压的变化表示,即v=
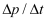 ,前2amin内正丁烷的平均反应速率v(正丁烷)=MPa·min-1。
,前2amin内正丁烷的平均反应速率v(正丁烷)=MPa·min-1。②若平衡时甲烷、乙烯的体积分数分别为
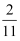 、
、 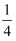 ,则该温度下反应I的压力平衡常数Kp=MPa(用平衡分压代替平衡浓度计算,分压一总压×物质的量分数,保留三位有效数字)。
,则该温度下反应I的压力平衡常数Kp=MPa(用平衡分压代替平衡浓度计算,分压一总压×物质的量分数,保留三位有效数字)。③若反应在恒温、恒压条件进行,平衡后反应容器的体积8.8L(填“>”“<”或“=”)。
④实际生产中发现高于640K后,乙烯和丙烯的产率随温度升高增加幅度减小,可能的原因是(任写1条)。
-
(3) 一种丁烷燃料电池工作原理如图所示。
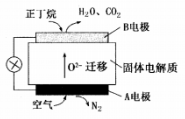
①A电极上发生的是反应(填“氧化“或“还原”)。
②写出B电极的电极反应式:。
催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:
2NO(g)+2CO(g)  N2(g)+2CO2(g)
N2(g)+2CO2(g)
-
(1) 已知:N2(g)+O2(g)
 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
化学键
O=O
C=O
C≡O
N≡N
键能(kJ/mol)
则反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H=kJ/mol。
N2(g)+2CO2(g) △H=kJ/mol。 -
(2) 氮氧化物和碳氧化物在催化剂作用下可发生反应:2CO+2NO(g)
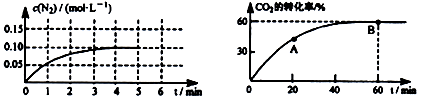
 N2+2CO2 , 在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=。
N2+2CO2 , 在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=。
-
(3) 用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
①A点的逆反应速率v逆(CO2)B点的正反应速率为v正(CO2)(填“>”、“<”或 “=”)。
-
(4) SO2可用氢氧化钠来吸收。现有0.4molSO2 , 若用200mL 3mol·L-1NaOH溶液将其完全吸收,生成物为(填化学式)。经测定所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为。
-
(5) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:。
-
(6) 已知常温下Fe(OH)3的Ksp=4.0×10-38。若某氢氧化镁溶液的pH=9,则该溶液中c(Fe3+)最大为。
![]()
-
(1) A,B,C之间有如图的转化关系,若A为AlCl3 , 写出A和C反应的离子方程式:;
-
(2) 检验Na2SO4和NaCl混合溶液中的Cl-的方法是:向少量混合液中加入足量a溶液,充分震荡后静置,然后取上层清液于试管中,再加入几滴b溶液,产生白色沉淀。试剂a、b分别是 、
-
(3) 已知H2、CO的燃烧热分别是akJ∕mol、bkJ∕mol,1mol液态水变为气态水吸收ckJ热量,C(s) + H2O(g)= CO(g)+ H2(g)△H=dkJ∕mol,写出碳(C)燃烧的热化学方程式。
-
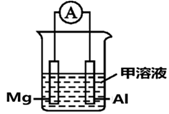
(4) Mg、Al设计成如图所示原电池装置:若电解液为盐酸,正极的电极反应为。若电解液为氢氧化钠溶液,负极的电极反应为。
-
(5) 写出用氢氧化钾做电解质溶液,甲醇(CH3OH)为燃料的负极的电极反应:。
-
(6) 若铅蓄电池负极质量增加19.2g,则其正极质量增加 g。
-
(1) I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)
 2NO(g) △H=+180 kJ·mol-1
2NO(g) △H=+180 kJ·mol-12CO(g)+O2(g)
 2CO2(g) △H=-564 kJ·mol-1
2CO2(g) △H=-564 kJ·mol-12NO(g)+2CO(g)
 2CO2(g)+N2(g) △H=。
2CO2(g)+N2(g) △H=。 -
(2) T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示。
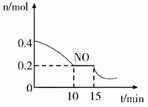
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=2MPa,则T℃时该反应的压力平衡常数Kp=;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,平衡将 (填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
-
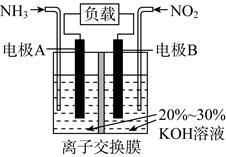
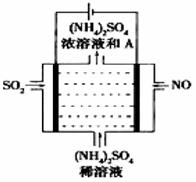
(3) II.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为g。


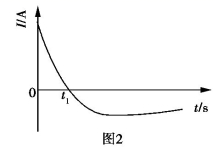
下列说法错误的是( )
 +2H++e−=NO2↑+H2O
C . t1后,原电池的正、负极发生互变
D . t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
+2H++e−=NO2↑+H2O
C . t1后,原电池的正、负极发生互变
D . t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
 B .
B . 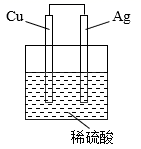 C .
C . 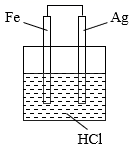 D .
D . 
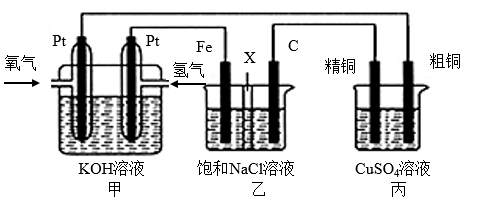
根据要求回答相关问题:
-
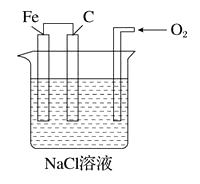
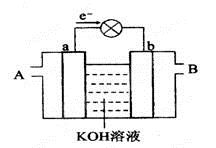
(1) 通入氢气的电极为(填“正极”或“负极”),该电极反应式为。
-
(2) 乙装置中石墨电极(C)为(填“阳极”或“阴极”),铁电极的电极反应式为。
-
(3) 反应一段时间后,如何检验乙装置中石墨电极的产物。
-
(4) 如果粗铜中含有锌、银、金等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将。(填“增大”、“减小”或“不变”)。
-
(5) 若在标准状况下,有2.24L氧气参加反应,则乙装置中(NaCl足量)C电极上生成的气体的物质的量为;丙装置中阴极析出铜的质量为。
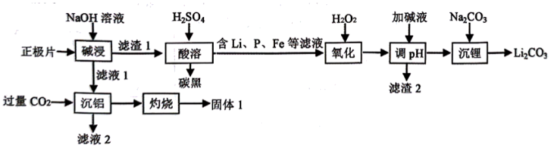
已知: I. 当离子浓度≤1.0×10-5 mol/L时,即认为该离子沉淀完全:
II.T℃时,Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
-
(1) “碱浸”的离子反应方程式是。
-
(2) “沉铝”所得滤液2中的物质 (填化学式) 经过处理可用于沉锂,从而实现联合生产;固体1常用法冶炼出金属。
-
(3) 加H2O2的目的是氧化,检验氧化已经完全的实验是;若将H2O2改为NaClO2也能达成目的,写出加NaClO2反应的离子方程式。
-
(4) “调pH”是使杂质离子形成氢氧化物而沉淀完全,溶液的pH值应不低于。
-
(5) 磷酸亚铁锂电池是一种具有较长使用寿命的二次电池,在充放电过程中表现出了良好的循环稳定性,放电时的总反应为:LixC6+Li1-xFePO4=6C+LiFePO4 , 则正极的电极反应式为。
-
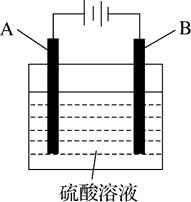
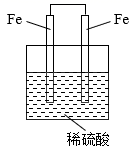
(1) 将铝片和铜片用导线相连,一组插入浓硝酸中,一 组插入烧碱溶液中,分别构成了原电池,在这两个原电池中,负极分别为____ (填字母)。A . 铝片、铜片 B . 铜片、铝片 C . 铝片、铝片
-
(2) 铅蓄电池在放电时发生的反应方程式为Pb+PbO2+2H2SO4=2PbSO4 +2H2O正极的电极反应式为。
-
(3) FeCl3溶液常用于腐蚀印刷电路铜板,反应原理为2FeCl3 +Cu=2FeCl2 +CuCl2 , 若将此反应设计成原电池,则负极所用电极材料为,当电路中转移0.2 mol电子时,被腐蚀的铜的质量为g。
-
(4) 燃料电池是一种高效、环境友好的供电装置。如图是电解质为稀硫酸的氢氧燃料电池原理示意图。
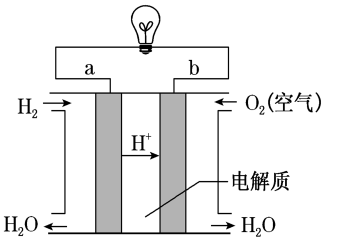
①正极的电极反应式为。
②电池工作一段时间后硫酸溶液的浓度(填“增大”、“减小”或“不变”)。




