第一节 原电池 知识点题库
下列方程式的书写或描述正确的是( )
A . 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3↓+SO42-
B . 热化学方程式C2H2(g)+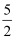 O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol
C . 铂电极电解MgCl2饱和溶液:MgCl2
O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol
C . 铂电极电解MgCl2饱和溶液:MgCl2
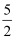 O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol
C . 铂电极电解MgCl2饱和溶液:MgCl2
O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol
C . 铂电极电解MgCl2饱和溶液:MgCl2
电解饱和食盐水,当阴极附近有0.8mol氢氧化钠生成时,导线中通过的电子的物质的量是( )
A . 0.16mol
B . 0.2mol
C . 0.4mol
D . 0.8mol
下列关于充电电池的叙述,不正确的是( )
A . 充电电池的化学反应原理是氧化还原反应
B . 充电电池可以无限制地反复放电、充电
C . 充电是使放电时的氧化还原反应逆向进行
D . 较长时间不使用电器时,最好从电器中取出电池,并妥善存放
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( )

A . 杠杆为导体或绝缘体时,均为A端高B端低
B . 杠杆为导体或绝缘体时,均为A端低B端高
C . 当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D . 当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
如图所示,装置中都盛有0.1mol/L 的NaCl 溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是( )

A . ①②③④
B . ②①③④
C . ③①④②
D . ②①④③
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )

A . 该装置中Pt极为阳极
B . 当c极的质量变化了2.16g时,a极上消耗的O2在标准状况下的体积为1.12L
C . 该装置中b极的电极反应式是:H2+2OH﹣﹣2e﹣=2H2O
D . 该装置中a极为正极,发生氧化反应
可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
A . 以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH-
B . 以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-═Al(OH)3↓
C . 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D . 电池工作时,电子通过外电路从正极流向负极
近几年,我国因为汽车尾气对环境的污染日趋严重,清洁能源的燃料电池汽车逐渐进入市场,已知甲烷的燃烧热为分别为890 KJ·mol-1 , 某电池用甲烷作为燃料,电池中以0.6molKOH溶液为电解质溶液,有关这类电池的说法不正确的( )
A . 这类电池的正极反应与金属的吸氧腐蚀正极反应相似。
B . 每转移1mol电子则这种电池产生电能为0.5度电
C . 电池的负极反应为:CH4+10OH-=CO32-+7H2O+8e-
D . 当消耗0.4mol燃料时,电池中的各种离子的浓度关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。下列说法正确的是( )
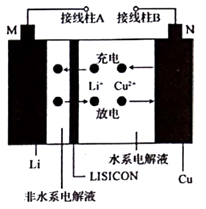
A . 陶瓷片允许水分子通过
B . 电池充电时,阴极反应为Li++e-=Li
C . 电池放电时,N极发生氧化反应
D . 电池充电时,接线柱B应与外接直流电源的负极相连
铝石墨双离子电池是一种全新低成本、高效电池。原理为:AlLi+Cx(PF6)  Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )
 Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )
Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )
A . 放电时,外电路中电子向铝锂电极移动
B . 放电时,正极反应为Cx(PF6)+e-=xC+PF6-
C . 充电时,应将铝石墨电极与电源负极相连
D . 充电时,若电路中通过1 mol电子,阴极质量增加9 g
如图所示的装置能够组成原电池产生电流的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
全球气候变暖已经成为全世界人类面临的重大问题,研究CO2的利用对促进低碳社会的构建具有重要意义。

-
(1) 利用“Na﹣CO 2”电池将CO 2变废为宝。我国科研人员研制出的可充电“Na﹣CO 2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2⇌2Na2CO3+C.放电时该电池“吸入”CO 2 , 其工作原理如图一所示:
①放电时,正极产物全部以固体形式沉积在电极表面,正极的电极反应式为。
②放电时,当转移0.1mol e-时,负极质量减少 g。
-
(2) 华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图二所示:
①上述生产过程的能量转化方式是。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2 , 电解质为熔融碳酸钠,则阳极放电的电极反应式为。
研究人员最近发现了一种水电池,这种水电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列水电池在海水中放电时的有关说法正确的是( )
A . 正极反应式:Ag+Cl--e-=AgCl
B . 每生成1molNa2Mn5O10转移2mol电子
C . Na+不断向水电池的负极移动
D . 电子从负极经外电路到正极,然后再经过内电路回到负极
某锂铜二次电池工作质理如图所示。在该电池中,水系电解液和非水系电解液被锂离子固体电解质陶瓷片(LISICON) 隔开。下列有关说法错误的是( )

A . 放电时,N极电极反应式为Cu2++2e -=Cu
B . Li+可以通过陶瓷片,水分子不能
C . 充电时,接线柱B应与电源的负极相连
D . 充电时,M电极发生还原反应
 电池放电时反应为
电池放电时反应为  ,下列说法错误的是( )
,下列说法错误的是( ) 
A . 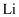 电极发生氧化反应
B . 溶液中
电极发生氧化反应
B . 溶液中  向
向  电极移动
C . 可用水代替电池中的有机物
D . 正极反应式为
电极移动
C . 可用水代替电池中的有机物
D . 正极反应式为 
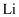 电极发生氧化反应
B . 溶液中
电极发生氧化反应
B . 溶液中  向
向  电极移动
C . 可用水代替电池中的有机物
D . 正极反应式为
电极移动
C . 可用水代替电池中的有机物
D . 正极反应式为 
如图是模拟工业电解饱和食盐水的装置图,下列叙述不正确的是( )
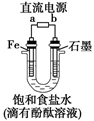
A . a 为电源的负极
B . Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑
C . 通电一段时间后,铁电极附近溶液先变红
D . 电解饱和食盐水的化学方程式是 2NaCl+2H2O  2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是( )

A . 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极
B . 电极b上发生的反应为:CH3OCH3-12e-+3H2O=2CO2+12H+
C . H+由b电极向a电极迁移
D . 二甲醚直接燃料电池能量密度( kW·h·kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍
生活中离不开化学。运用化学知识回答下列问题。
-
(1) 氢气、丙烷是重要的燃料,计算等质量的氢气完全燃烧产生的热量是丙烷完全燃烧产生的热量的倍(精确到小数点后二位)。(已知:氢气、丙烷的燃烧热分别为:286kJ•
 ,2217. 6 kJ•
,2217. 6 kJ•  )
)
-
(2) NH4Al(SO4)2在食品加工中是一种合法的食品添加剂,它还是一种净水剂,其净水的理由是(用化学用语回答)。
-
(3) 龋齿是有机酸使牙齿中的Ca5(PO4)3(OH)溶解造成的。使用含氟牙膏会使其转化为Ca5(PO4)3F抵抗酸的腐蚀,含氟牙膏能使牙断中Ca5(PO4)3(OH)转化为Ca5(PO4)3F的理由足:溶解度Ca5(PO4)3(OH)Ca5(PO4)3F(填“﹥”或“﹤”)。
-
(4) 目前民用电池的主要成分是碱性锌锰电池,该电池的总反应式为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2 , 该电池放电时,负极的电极反应式为。
硼酸 大量应用于玻璃工业,能改善玻璃制品性能。通过电解
大量应用于玻璃工业,能改善玻璃制品性能。通过电解 溶液的方法可以制备硼酸,工作原理如图。下列叙述不正确的是( )
溶液的方法可以制备硼酸,工作原理如图。下列叙述不正确的是( )
 大量应用于玻璃工业,能改善玻璃制品性能。通过电解
大量应用于玻璃工业,能改善玻璃制品性能。通过电解 溶液的方法可以制备硼酸,工作原理如图。下列叙述不正确的是( )
溶液的方法可以制备硼酸,工作原理如图。下列叙述不正确的是( )
A . N为电源正极
B . 产品室中的反应为 C . b膜为阳离子交换膜
D . 每生成
C . b膜为阳离子交换膜
D . 每生成 , 两极共生成标准状况下16.8L气体
, 两极共生成标准状况下16.8L气体
 C . b膜为阳离子交换膜
D . 每生成
C . b膜为阳离子交换膜
D . 每生成 , 两极共生成标准状况下16.8L气体
, 两极共生成标准状况下16.8L气体
环氧乙烷( )气体是一种重要的工业原料。一种制备环氧乙烷的装置原理如图所示。电解时向其中一电极区持续通入乙烯,充分电解后,将两电极区溶液混合反应可制得环氧乙烷。下列说法错误的是 ( )
)气体是一种重要的工业原料。一种制备环氧乙烷的装置原理如图所示。电解时向其中一电极区持续通入乙烯,充分电解后,将两电极区溶液混合反应可制得环氧乙烷。下列说法错误的是 ( )

A . 电解时 将移向阴极区
B .
将移向阴极区
B .  与
与 的反应为加成反应
C . 电路中每转移
的反应为加成反应
C . 电路中每转移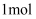 电子,则理论上可生成
电子,则理论上可生成 D . 两电极区溶液混合生成环氧乙烷的离子反应为HOCH2CH2Cl+OH-→
D . 两电极区溶液混合生成环氧乙烷的离子反应为HOCH2CH2Cl+OH-→ ↑+H2O+Cl-
↑+H2O+Cl-
 将移向阴极区
B .
将移向阴极区
B .  与
与 的反应为加成反应
C . 电路中每转移
的反应为加成反应
C . 电路中每转移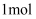 电子,则理论上可生成
电子,则理论上可生成 D . 两电极区溶液混合生成环氧乙烷的离子反应为HOCH2CH2Cl+OH-→
D . 两电极区溶液混合生成环氧乙烷的离子反应为HOCH2CH2Cl+OH-→最近更新



