第二单元 物质的获取 知识点题库
-
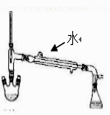
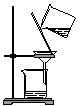
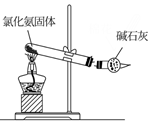
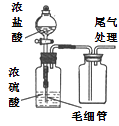
(1) 仪器a的名称为,装置A的圆底烧瓶中发生反应的化学方程式为,为保持装置C为无水环境,装置B中加入的试剂是。
-
(2) 实验步骤:如图连接装置后,先(填实验操作),再装药品,然后点燃(填“A”或“C”)处酒精灯,当(填实验现象)时,再点燃(填“A”或“C”)处酒精灯。
-
(3) 装置D的作用是,。
-
(4) 甲同学认为进入装置C的气体中混有HCl,应在装置B前增加装有(填试剂名称)的洗气装置除去;乙同学认为不需要除去HCl,理由为。
选项 | A | B | C | D |
装置 |
|
|
|
|
目的 | 快速制取少量HCl气体 | 测定不同浓度的 | 制备并收集乙酸乙酯 | 从小苏打溶液中提取 |
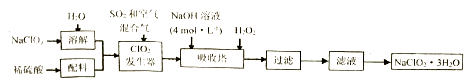
已知:①亚氯酸钠(NaClO2)受热易分解;
②NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
③ClO2常温下为黄绿色气体,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10% 以下更安全。
回答下列问题:
-
(1) 在ClO2发生器中通入空气的作用是
-
(2) 吸收塔中发生反应的化学方程式为:
-
(3) 由滤液
 NaClO2·3H2O,需采取的操作是在55C的条件下减压蒸发、、洗涤、干燥。工业上通常采用“减压蒸发”而不用“常压蒸发”,原因是;结晶后需要对晶体洗涤,为了减少损失,可以用洗涤晶体。
NaClO2·3H2O,需采取的操作是在55C的条件下减压蒸发、、洗涤、干燥。工业上通常采用“减压蒸发”而不用“常压蒸发”,原因是;结晶后需要对晶体洗涤,为了减少损失,可以用洗涤晶体。
-
(4) 在碱性溶液中NaClO2比较稳定,在酸性溶液中, ClO2-和H+结合为HClO2 , HClO2是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,试写出HClO2分解的化学方程式。
|
|
|
|
A.蒸馏 | B.块状固体得取用 | C.过滤 | D.用试管给液体加热 |
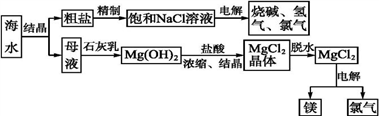
试回答下列问题:
-
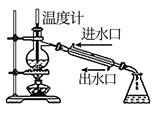
(1) 粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液。精制过程中所用试剂有a、BaCl2溶液、b、Na2CO3溶液、c、 NaOH溶液、d、盐酸。加入试剂顺序正确的是______;A . a.b.c.d B . c.b.a.d C . b.a.d.c D . a.c.b.d
-
(2) 写出电解饱和食盐水方程式,产生的Cl2和烧碱反应能生成(填商品名称),反应方程式。
-
(3) 海水中提取食盐后的母液中含有K+、Na+、Mg2+等。从离子反应的角度考虑,向母液中加入石灰乳的作用是。
-
(4) 电解熔融的氯化镁所得的镁蒸气冷却后即为固体镁,可以冷却镁蒸气的气体氛围为_____。A . H2 B . CO2 C . 空气 D . Ar
| | | | |
| A.除去水中泥沙 | B.收集氨气 | C.分离CCl4和H2O | D.配制100 mL 0.1 mol·L−1 NaCl溶液 |
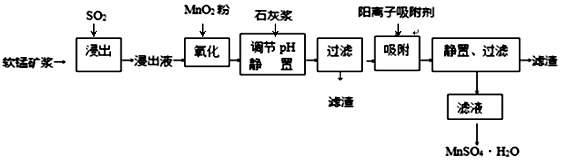
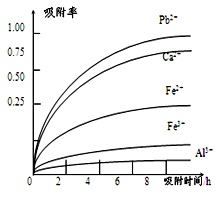
已知:浸出液的pH<2,其中的金属离子主要是Mn2+ , 还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
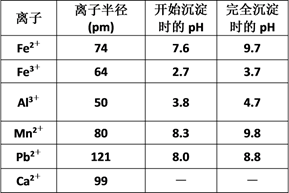
-
(1) 浸出过程中生成Mn2+反应的化学方程式为,
-
(2) Fe2+被氧化的过程中主要反应的离子方程式。
-
(3) 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至范围。
-
(4) 阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有等(写二点)。
-
(5) 吸附步骤除去的主要离子为。
-
(6) 电解MnSO4、ZnSO4和H2SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式。
-
(7) CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是。
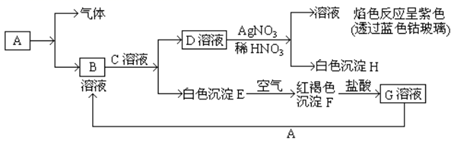
请回答下列问题:
-
(1) 写出B的化学式,D的化学式为;
-
(2) 写出由E转变成F的化学方程式。
-
(3) 写出D转化成H的离子方程式。
-
(4) 除去溶液B中混有的少量G溶液的最适宜方法是。
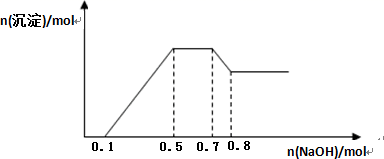
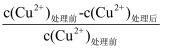 ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1 , Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是( )
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1 , Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是( ) 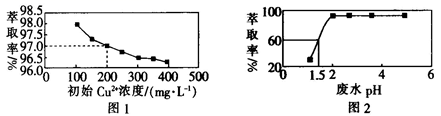
-
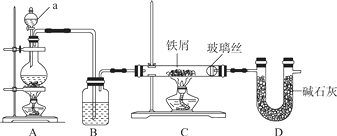
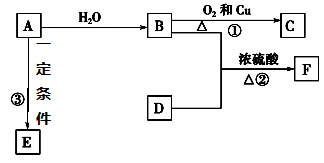
(1) A的结构式为,F的名称为。
-
(2) 写出反应的化学方程式
①,反应类型为。
②,反应类型为。
③
-
(3) 实验室怎样鉴别B和D?。
-
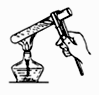
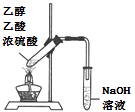
(4) 在实验室里我们可以用如图所示的装置来制取F,乙中所盛的试剂为,该装置图中有一个明显的不正确是。
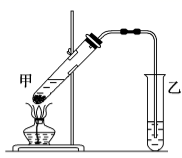
-
(5) 写出F的同分异构体中与D互为同系物的有机物的所有结构简式:。
| 选项 | 实验操作和现象 | 结论 |
| A | 分别将少量钠投入到盛有水和乙醇的的烧杯中,均有气体产生 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
| B | 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的氯甲烷具有酸性 |
| C | 室温下,向苯酚钠溶液中通入 | 碳酸的酸性比苯酚的强 |
| D | 向20%蔗糖溶液中加入少量稀硫酸,加热;再加入银氨溶液,加热;未出现银镜 | 蔗糖未水解 |

-
(1) 搅拌的目的是,乙中不能采用加热措施,可能的原因是;
-
(2) 乙中发生的化学反应方程式为;
-
(3) 滤液X中,除水外还可以循环利用的物质是;
-
(4) 检验CaO2·nH2O是否洗涤干净的方法是;
-
(5) 取上述制得的CaO2·nH2O晶体进行热重分析,其热分解时晶体的质量随温度变化的曲线如图,则过氧化钙晶体(CaO2·nH2O)的化学式为。
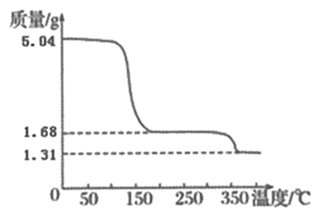
 、无水乙醇、己烯中分别滴加少量溴水,振荡、静置后,描述错误的是( )
、无水乙醇、己烯中分别滴加少量溴水,振荡、静置后,描述错误的是( )
 :上层无色,下层紫色
:上层无色,下层紫色
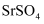 ,还含有少量
,还含有少量 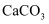 和
和 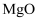 杂质)为原料生产具有光催化活性的钛酸锶
杂质)为原料生产具有光催化活性的钛酸锶 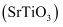 ,工艺流程如下:
,工艺流程如下: 
已知氢氧化锶和氢氧化钙在水中的溶解度曲线如图1所示。回答下列问题:

-
(1) 天青石与过量焦炭隔绝空气“焙烧”,该过程中
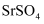 发生反应的化学方程式为。
发生反应的化学方程式为。
-
(2) “酸浸”时产生的有毒气体
 可用
可用  溶液吸收,写出该反应的离子方程式。
溶液吸收,写出该反应的离子方程式。
-
(3) “除杂”的方法是将溶液升温至95℃,同时加入
 溶液调节
溶液调节  。经过“一系列操作”,包括:,收滤液,即可得到
。经过“一系列操作”,包括:,收滤液,即可得到  晶体。“滤渣”的成分为。
晶体。“滤渣”的成分为。
-
(4)
 经“转化”、“共沉淀”,过滤、洗涤、干燥得到纯净的草酸氧钛锶晶体
经“转化”、“共沉淀”,过滤、洗涤、干燥得到纯净的草酸氧钛锶晶体  。请简述洗涤的操作。草酸氧钛锶晶体经“煅烧”分解成钛酸锶,写出对应的化学方程式。
。请简述洗涤的操作。草酸氧钛锶晶体经“煅烧”分解成钛酸锶,写出对应的化学方程式。
-
(5) 光催化技术具有高效、节能的优点,利用钛酸锶光催化还原
 有利于实现“碳中和”,其质理如图2所示,写出铂电极的电极反应式。
有利于实现“碳中和”,其质理如图2所示,写出铂电极的电极反应式。 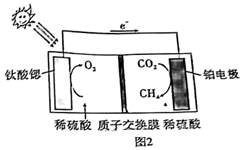
-
(6) 天青石也可作为冶炼金属锶的原料。依据锶在元素周期表中的位置分析锶的冶炼方法是___________。A . 电解法 B . 热分解法 C . 热还原法
| A | B | C | D |
| | | | |
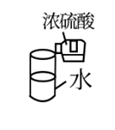
| 稀释浓硫酸 | 制备氨气 | 检查装置的气密性 | 制备蒸馏水 |
几种金属离子生成氢氧化物沉淀的pH见表:
氢氧化物 | Fe(OH)3 | Zn(OH)2 | Cd(OH)2 | Cr(OH)3 |
开始沉淀的pH | 1.5 | 8 | 7.2 | 6 |
沉淀完全的pH | 3.3 | 12 | 9.5 | 8 |
请回答下列问题:
-
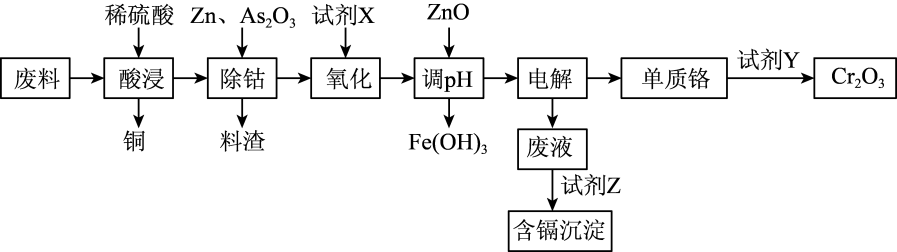
(1) 写出提高酸浸速率的措施(写出两点)。
-
(2) 酸浸时形成的金属离子的价态均相同,料渣中含有大量的CoAs合金,写出除钴时反应的离子方程式;若仅从试剂的经济角度考虑,试剂X最好是;氧化过程中铁、铬形成的离子均被氧化,则调pH时应将pH控制在范围内,单质铬与试剂Y反应时,反应中二者消耗量n(Cr):n(Y)=。
-
(3) 设计实验检验废液中是否含有Fe3+:。
-
(4) 已知常温下Ksp(CdCO3)=5.2×10-12 , Ksp(CdS)=3.6×10-29。试剂Z是(填“Na2CO3”或“Na2S”)时,Cd2+的去除效果较好。若用Na2S溶液处理CdCO3后,达到沉淀溶解平衡时溶液中c(S2-)=amol·L-1 , 则c(
 )=。
)=。
 )是一种环保、高效、多功能的饮用水处理剂,制备流程如图所示:
)是一种环保、高效、多功能的饮用水处理剂,制备流程如图所示: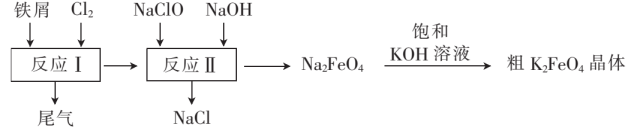
下列叙述错误的是( )
 对饮用水杀菌消毒的同时,还能吸附杂质起到净化饮用水的作用
B . 用
对饮用水杀菌消毒的同时,还能吸附杂质起到净化饮用水的作用
B . 用 溶液吸收反应Ⅰ中尾气后可再利用
C . 反应Ⅱ中氧化剂与还原剂的物质的量之比为3:2
D . 该生产条件下,物质的溶解性:
溶液吸收反应Ⅰ中尾气后可再利用
C . 反应Ⅱ中氧化剂与还原剂的物质的量之比为3:2
D . 该生产条件下,物质的溶解性:
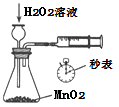

 溶液对产生
溶液对产生  速率的影响
速率的影响 晶体
晶体