第二单元 物质的获取 知识点题库
|
|
|
|
A.制蒸馏水 | B.油、水分离 | C.沙、水分离 | D.干燥NH3 |
-
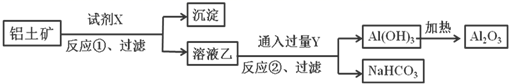
(1) 上面所列物质中,属于电解质的是填序号,下同),属于非电解质的是。
-
(2) 物质②的颜色是;物质⑦的化学式。
-
(3) 若要提取⑤中的碘,所用的萃取剂可以是_____。A . 四氯化碳 B . 酒精 C . 淀粉溶液 D . 苯
-
(4) 某同学取物质⑩配制溶液,观察溶液颜色是色,向溶液中加入 NaOH 溶液时, 生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,写出这一过程中反应的化学方程 式:。
| 选项 | 物质 | 方法 |
| A | CaO粉末(CaCO3) | 加入过量的水,充分搅拌后过滤 |
| B | CuSO4溶液(H2SO4) | 加入过量CuO粉末,微热,充分反应后过滤 |
| C | NaOH溶液[Ca(OH2)] | 加入过量碳酸钠溶液,充分反应后过滤 |
| D | Fe(Fe2O3) | 加入过量稀盐酸,充分反应后过滤 |
a.汽油中不小心混入了大量的水;
b.水与丙酮的混合物,已知:丙酮是一种可与水混溶的无色液体,密度小于水,沸点约为56℃。

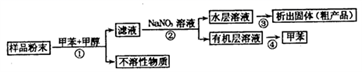
下列关于该流程中各步骤的说法中,不正确的是( )
| 选项 | 步骤 | 采用装置 | 主要仪器 |
| A | ① | 过滤装置 | 漏斗 |
| B | ② | 分液装置 | 分液漏斗 |
| C | ③ | 蒸发装置 | 坩埚 |
| D | ④ | 蒸馏装置 | 蒸馏烧瓶 |

回答下列问题:
-
(1) 操作A是(填实验基本操作名称)。
-
(2) 操作B需加入下列试剂中的一种,最合适的是。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
-
(3) 上图中虚线框内流程的主要作用是。写出溴水中通入SO2时反应的离子方程式
-
(4) 无水MgCl2在熔融状态下,通电后会产生Mg和Cl2 , 该反应的化学方程式为。
-
(1) I.甲方案
实验原理:
实验步骤:

判断
 沉淀完全的操作为。
沉淀完全的操作为。 -
(2) 步骤②判断沉淀是否洗净所选用的试剂为。
-
(3) 步骤③灼烧时盛装样品的仪器名称为。
-
(4) 若步骤①从烧杯中转移沉淀时未洗涤烧杯,则测得c(CuSO4)(填“偏高”、“偏低”或“无影响”)。
-
(5) II.乙方案
实验原理:
 、
、 
实验步骤:
①按如图安装装置(夹持仪器略去)

②……
③在仪器A、B、C、D、E中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
步骤②为。
-
(6) 步骤⑥需保证体系恢复到室温的原因是(填序号)。
a.反应热受温度影响 b.气体密度受温度影响 c.反应速率受温度影响
-
(7) Zn粉质量为a g,若测得H2体积为b mL,已知实验条件下
 ,则c(CuSO4)mol·L−1(列出计算表达式)。
,则c(CuSO4)mol·L−1(列出计算表达式)。
-
(8) 若步骤⑥E管液面高于D管,未调液面即读数,则测得c(CuSO4)(填“偏高”、“偏低”或“无影响”)。

请回答:
-
(1) 步骤I加入乙醇的目的是。
-
(2) 验证步骤II中反应已完全的操作是。
-
(3) 步骤III加入60 mL热饱和食盐水,充分搅拌,冷却后即有脂肪酸钠固体析出,若直接用冷的饱和食盐水,则所得皂基容易吸水糊化,使用饱和食盐水的目的是;必须使用热饱和食盐水的原因是。
-
(4) 向皂化尾液中滴入新制Cu(OH)2 , 振荡,溶液呈绛蓝色,该反应的化学方程式为。
-
(5) ①查阅资料,一种从皂化尾液中分离提纯甘油(丙三醇)的工艺:先向皂化尾液中加入3倍体积的正丁醇;随着正丁醇的加入,皂化尾液中的盐分会结晶析出,液相分为上层有机相和下层水相;上层有机相经过精馏(一种蒸馏方法),回收正丁醇,同时除去水,并得到高纯度甘油;下层水相过滤,滤液回流至萃取塔内再处理,结晶的氯化钠洗涤回收。
下列说法正确的是。
A.正丁醇与水可以任意比例互溶 B.氯化钠在正丁醇中溶解度小
C.分层后甘油全在有机相,水相中没有残留 D.正丁醇的沸点低于甘油
②小组采用下图装置模拟分离提纯甘油(夹持装置和加热装置已略去,毛细管的作用是防止暴沸)。

请选择正确的操作并按序排列:装配好蒸馏装置→检查装置的气密性→向蒸馏烧瓶加入适量皂化尾液→打开真空泵→接通冷凝水→给蒸馏烧瓶加热→→→→→拆除装置。
a.收集甘油,至温度计读数开始增大时;b.收集正丁醇与水的混合物,至温度计读数开始增大时;c.等体系内外压力平衡后关闭真空泵;d.无馏出物后,关闭冷凝水;e.移去热源。
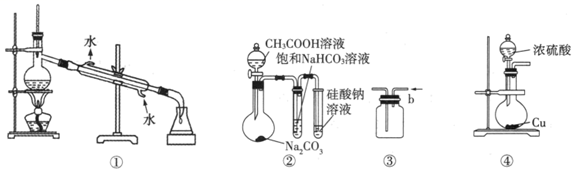
 C . 利用装置③,由b口进气可收集
C . 利用装置③,由b口进气可收集  、
、  D . 利用装置④可制备二氧化硫气体
D . 利用装置④可制备二氧化硫气体
|
十八醇 |
丙烯酸 |
甲苯 |
丙烯酸十八酯 |
|
|
|
相对分子质量 |
270 |
72 |
92 |
324 |
|
|
密度/g•cm-3 |
0.81 |
1.05 |
0.90 |
0.80 |
|
|
沸点/℃ |
210 |
141 |
110.6 |
402 |
|
|
说中溶解度 |
难溶 |
可溶 |
难溶 |
难溶 |
|
|
实验步骤: Ⅰ.向仪器甲中依次加入十八醇(C18H37OH)、阻凝剂、携水分 剂,安装好其他仪器。 Ⅱ.搅拌、加热,瓶内试剂完全溶解后加入丙烯酸、催化剂,加热至回流温度115~120℃,待分水器水量达到理论量时停止甲加热。 Ⅲ.取甲中产物倒入分液漏斗中,先后用5%Na2CO3溶液和蒸馏水多次洗涤,分液后有机层加入无水MgSO4 , 静置、过滤,得粗产品,进一步提纯,得纯净产品。 |
|||||
回答下列问题:
-
(1) 仪器甲名称,仪器乙的作用为。
-
(2) 步骤Ⅱ生成丙烯酸十八酯的反应方程式为,保持回流温度恒定可采用的加热方式为(填标号)
a.沸水浴 b.盐浴 c.电加热套 d.油浴
-
(3) 为将反应生成的水及时移出,需加入携水剂。实验选用甲苯做携水剂的原因。
-
(4) 用5%Na2CO3溶液水洗的目的,加入无水MgSO4的目的。
-
(5) 步骤Ⅲ进一步提纯,在该提纯步骤中会用到的仪器有(填标号)。


-
(1) 仪器a的名称是;实验前,第一步操作是。
-
(2) 在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是。
-
(3) 如表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是。
方案
反应物
甲
Cu、浓HNO3
乙
Cu、稀HNO3
丙
Cu、O2、稀HNO3
-
(4) 该装置也可用来证明酸性强弱:如H2CO3>H2SiO3。
方法如下:在a中加入稀硫酸,c中加入的试剂是 (填编号,下同),d中加入的试剂是;如果在d中看到,即可证明酸性:H2CO3>H2SiO3。
供选择的试剂:
A.Na2SiO3溶液 B.稀硫酸 C.NaCl溶液 D.Na2CO3溶液 E.碳酸钙
 、
、 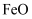 、
、  、
、  和可燃性有机物,现利用下列工艺流程回收部分金属及金属化合物:
和可燃性有机物,现利用下列工艺流程回收部分金属及金属化合物: 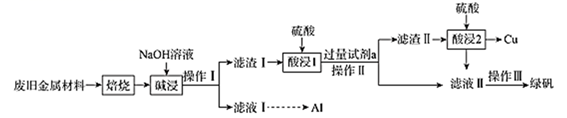
已知:绿矾为  。回答下列问题:
。回答下列问题:
-
(1) “焙烧”的目的是将金属单质转化为氧化物,并除去。
-
(2) NaOH的电子式为,“碱浸”时发生反应的固体为。
-
(3) “操作Ⅰ”的名称为。
-
(4) 试剂a为(填化学式),加入试剂a后可能发生的反应(写出其中1个反应的离子方程式即可)。
-
(5) 滤液Ⅱ中可能含有因氧气的作用而产生的少量(填离子符号),设计实验检验滤液Ⅱ中是否含有上述离子:。

已知:25℃时溶液中金属离子物质的量浓度c与pH的关系如图甲所示:

回答下列问题:
-
(1) 原料预处理的目的是加快煅烧反应速率,提高原料利用率。预处理方式可以是。
-
(2) “高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。则“高温煅烧”的主要反应化学方程式为。
-
(3) 气体2为。步骤1的目的为,不设置步骤1带来的后果是。
-
(4) “除铁铝”过程维持温度在75℃的好处是。“除铁铝”后溶液温度降至室温(25℃),溶液中c(Fe3+)为mol/L。(100.9=7.9)
-
(5) ①写出“沉锶”的离子反应方程式:。
②反应温度对锶转化率的影响如图乙,温度高于60℃时,锶转化率降低的原因为。


-
(1) 仪器a的名称为。
-
(2) 装置甲中发生反应的化学方程式为。
-
(3) 装置乙中饱和食盐水的作用是。
-
(4) 装置丁中收集氯气的方法是,在装满氯气的集气瓶中放入红色鲜花,观察到鲜花褪色,原因是。
-
(5) 装置戊中发生反应的离子方程式为。
-
(6) 充分反应后,将氯离子传感器插入广口瓶丙的溶液中,与数据采集器,计算机连接,用强光照射瓶中溶液,采集数据所得图像如图所示。

①A点溶液发生分解反应的离子方程式为。
②A点溶液中氯元素的存在形式有
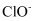 和。
和。