第二单元 物质的获取 知识点题库

-
(1) 为提高锌灰的浸取率,可采用的方法是(填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
-
(2) 步骤Ⅱ所得滤渣中的物质是(写化学式)。
-
(3) 步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为。
-
(4) 步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,化学反应方程式为;
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图,从滤液中得到Na2SO4·10H2O的操作方法是。

-
(5) 若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液.则理论上所用锌灰中含有锌元素的质量为。
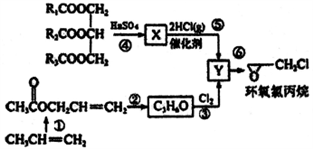
完成下列填空:
-
(1) X的结构简式Y中的不含氧官能团的名称为
-
(2) 反应①中的合成原料还有O2和醋酸及催化剂,写出该反应的化学方程式。
-
(3) 下列说法错误的是__________A . 如R1、R2、R3不完全相同,则
 是混合物
B . Y的结构简式是不能确定的,可能有两种不同的结构
C . 反应②④⑤⑥都是取代反应
D . X与乙醇不是同系物,两者都能使酸性KMnO4溶液褪色
是混合物
B . Y的结构简式是不能确定的,可能有两种不同的结构
C . 反应②④⑤⑥都是取代反应
D . X与乙醇不是同系物,两者都能使酸性KMnO4溶液褪色
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体

-
(1) 装置的连接顺序为a→→→→→b→c→f。
-
(2) 硬质玻璃管与收集器之间没有用导管连接,这样做的优点是。
-
(3) 反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

试剂X中溶质的化学式为;固体产物的成分可能为(填字母)。
A.Fe和FeCl3
B.FeCl2 和FeCl3
C.Fe、FeCl2和FeCl3
D.Fe和FeCl2
-
(4) 加入少许植物油的作用是,加入新制氯水后溶液红色加深的原因:(用离子方程式表示)。
-
(5) 现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为。(计算结果保留两位有效数字)
| 选项 | 实验目的 | 操作 |
| A | 取20.00 mL盐酸 | 在25 mL酸式滴定管中装入盐酸。调整初始读数为5.00 mL后,将剩余盐酸全部放入锥形瓶中 |
| B | 测量饱和Na2CO3溶液的pH值 | 用蒸馏水湿润pH试纸,放入Na2CO3溶液中,观察pH试纸颜色,并与比色卡对比,读出pH值 |
| C | 制取纯净的FeCl 3固体 | 加热蒸干FeCl3溶液 |
| D | 验证Ksp[Cu(OH)2]< Ksp[Mg(OH)2] | 将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol/L CuSO4溶液 |
已知: ![]()

![]() +H2O
+H2O
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
-
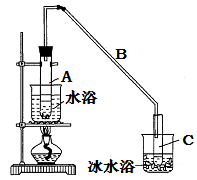
(1) 制备粗品:将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是。
②导管B除了导气外还具有的作用是。
-
(2) 制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用 (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水应从口进入,目的是使冷却水与气体形成逆流方向。

③收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
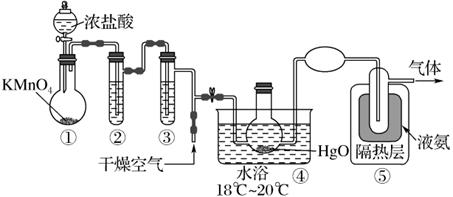
已知:Cl2O 的熔点为-116℃,沸点为3.8℃;NH3的沸点为-33.5 ℃;Cl2 的沸点为-34.6 ℃;HgO+2Cl2=HgCl2+Cl2O。下列说法中错误的是( )
 B .
B . 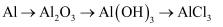 C .
C .  D .
D . 
| 实验 | 操作 | |
| A | 稀释浓硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B | 除去NaHCO3固体中的少量Na2CO3杂质 | 将固体加热至恒重 |
| C | 浓盐酸与MnO2反应制备纯净Cl2 | 将气体产物先通过盛有浓硫酸的洗气瓶,后通过盛有饱和食盐水的洗气瓶。 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
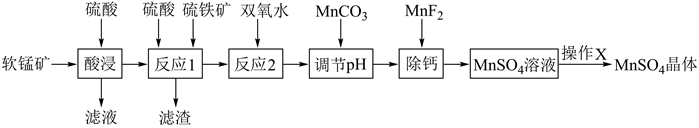 资料:
资料:
①硫铁矿主要成分FeS2 , 杂质不参与反应
②该工艺条件下,各金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe3+ | Fe2+ | Mg2+ | Mn2+ |
| 开始沉淀的pH | 2.1 | 7.5 | 9.6 | 9.3 |
| 完全沉淀的pH | 3.2 | 8.9 | 11.1 | 10.8 |
③该工艺条件下,CaSO4微溶于水
-
(1) “酸浸”时为加快反应速率除加热外,还可采取的措施有。(写一条即可)
-
(2) “酸浸”过程能否用浓盐酸代替硫酸?,(填“能”或“否”)理由是。
-
(3) 反应1中FeS2和MnO2颗粒组成两个原电池,如图所示:其中,MnO2原电池反应迅速,而FeS2原电池由于生成的硫覆盖在FeS2颗粒表面,溶解速率受阻变慢。

①MnO2原电池中,MnO2为原电池的(填“正极”或“负极”),发生的电极反应式为:。
②FeS2原电池中,FeS2为原电池的(填“正极”或“负极”)。电极产物是。
-
(4) 加入MnCO3调节pH可以将滤液中的Fe3+转化为Fe(OH)3而除去,配平发生反应的离子方程式:。
3MnCO3+2Fe3++
 =3Mn2++2Fe(OH)3+
=3Mn2++2Fe(OH)3+ 
-
(5) 反应1后的滤液中所含金属阳离子有Mn2+、。
-
(1) I.下列装置可以完成氨气制备的一系列实验:

大试管中发生反应的化学方程式为。 -
(2) 组装制取并收集纯净干燥NH3的装置:a(填接口字母)
-
(3) 检验溶液中NH
 的操作和现象是。
的操作和现象是。
-
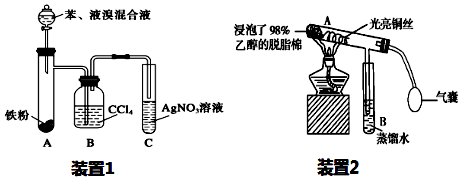
(4) II.化学小组探究“Fe+2Ag+=Fe2++2Ag”反应的实验,过程如下:向0.05mol·L-1AgNO3溶液滴入少量HNO3 , 至pH≈2,再加入过量铁粉,振荡后静置10分钟,试管底部有黑色固体,上层溶液呈浅黄色。
初步探究反应产物:
实验序号
实验操作
实验现象及结论
ⅰ
取上层清液于试管中,滴入酸性高锰酸钾溶液,振荡
溶液紫色褪去,说明溶液中含有离子:。
ⅱ
取少量黑色固体,洗涤后,加稀硝酸溶解固体,再加盐酸
观察到白色沉淀,证明黑色固体中含有Ag.
-
(5) 探究“溶液呈浅黄色”的原因:
①甲认为铁粉过量时不可能有Fe3+ , 理由是(用离子方程式表示)。
②乙认为溶液呈浅黄色肯定有Fe3+ , 对在此实验条件下Fe3+产生的原因作出如下假设:
假设I:空气中的O2将Fe2+氧化;
假设Ⅱ:PH≈2为酸性溶液,NO
 具有氧化性,将Fe2+氧化;
具有氧化性,将Fe2+氧化;假设Ⅲ:溶液中的Ag+将Fe2+氧化。
乙同学设计实验验证:
实验序号
实验操作
实验现象及结论
ⅲ
向0.05mol·L-1NaNO3溶液滴入少量HNO3 , 至pH≈2,加入过量铁粉,振荡后静置,分别取不同反应时间后的上层清液,滴加KSCN溶液。
3分钟时的溶液呈浅红色,30分钟时的溶液几乎无色。
iv
取实验iii中反应30分钟时溶液的上层清液加溶液,静置,再滴加KSCN溶液
有黑色固体析出,加KSCN溶液后,溶液变红。
③实验结论,则假设(填序号)正确。
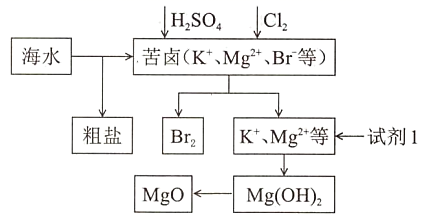
 需依次加入
需依次加入 溶液、
溶液、 溶液、稀HCl除去
B . 苦卤中提溴反应的离子方程式为
溶液、稀HCl除去
B . 苦卤中提溴反应的离子方程式为 C . 工业上“试剂1”最好选择石灰乳
D . 工业上电解熔融的MgO可冶炼金属Mg
C . 工业上“试剂1”最好选择石灰乳
D . 工业上电解熔融的MgO可冶炼金属Mg
选项 | 物质(杂质) | 所用试剂 | 分离方法 |
A |
| 饱和碳酸钠溶液 | 洗气 |
B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
C | 溴苯(溴) | 用 | 分液 |
D | 乙醇(水) | 无水硫酸铜 | 蒸馏 |

供选试剂:Na2SO4溶液、K2SO4溶液、K2CO3溶液、盐酸
-
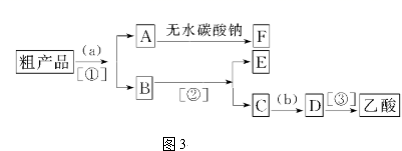
(1) 操作①、②的名称分别是、。
-
(2) 试剂a是,固体B是。(填化学式)
-
(3) 生成沉淀A的离子反应方程式为。加入试剂b所发生的化学反应方程式为。
-
(4) 该方案能否达到实验目的:。若不能,应如何改进(若能,此问不用回答)。
 溶液洗涤
溶液洗涤


