第二单元 物质的获取 知识点题库
实验操作 | 现象 | 结论 | |
A | 将少量的饱和硼酸溶液滴加到碳酸钠溶液中 | 无气泡 | Ka2H2 CO3>H3BO3 |
B | 向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制备的Cu(OH)2悬浊液并加热 | 无红色沉淀 | 蔗糖未水解 |
C | 将浸透了石蜡油的石棉放置在硬质试管底部,加入少量碎瓷片,并加强热,将生成的气体通入酸性高锰酸钾溶液 | 溶液褪色 | 石蜡油分解产物中含有不饱和烃 |
D | 向1mL2mol/L的NaOH溶液中,滴加1-2滴1mol/ L MgCl2溶液,再滴加2滴1mol/ L FeCl3溶液 | 先有白色沉淀,后有红褐色沉淀 | Ksp:Mg(OH)2>Fe(OH)3 |
【实验过程】
(一)铝的回收
①称取16.0g废弃电池原料;
②用98.3%的硫酸进行酸浸、稀释、除杂、过滤;
③将滤液蒸干得到硫酸铝固体mlg.
(二)草酸铝的制备
④配制250mL0.20mol/L的硫酸铝溶液;
⑤量取0.10mol/L的草酸铵溶液20.00mL,并加入一定量的分散剂,缓缓加入配制的硫酸铝溶液25.00mL,搅拌lh;
⑥沉化、抽滤、洗涤、干燥、称量固体质量为m2g。
【问题讨论】
-
(1) 在用98.3%的硫酸进行酸浸时,浸出率与条件的关系如图所示:
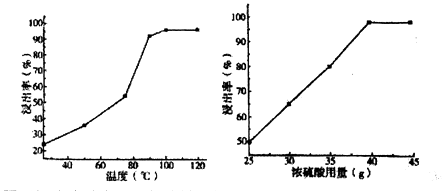
由图可知浓硫酸为浸取剂的最佳条件为。
-
(2) 步骤③蒸干溶液所需的仪器有带铁圈的铁架台、酒精灯、、。
-
(3) 铝的回收率为 (回收率=回收铝的质量/原料的质量)。
-
(4) 步骤⑥中洗涤晶体时先用蒸馏水再用乙醇洗涤,这样洗涤的原因是。
-
(5) 该研究小组在实验过程中发现,若用0.90mol/L草酸铵进行实验,会导致沉淀的质量远超过实际草酸铝的质量。经分析,结晶生成物为(NH4)xAly(C2O4)z·nH2O。 现称取3.990g该结晶水合物进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示。已知450℃时剩余固体只有Al2O3。第II阶段共产生气体2.016L (标准状况),该气体通入足量的石灰水中产生3.000g沉淀。请计算求出该结晶水合物的化学式为。


主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入6mol/L的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请回容以下问题:
-
(1) 装置中干燥管B的作用是。
-
(2) 如果将分浓漏斗中的硫酸换成浓度相同的盐酸,测试的结果(填偏高、偏低或不变);
-
(3) 步骤⑤的目的是。
-
(4) 步骤⑦的目的是。
-
(5) 该试样中纯碱的质量分数的计算式为。
丙炔酸甲酯(  )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
![]()
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
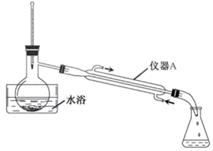
步骤2:蒸出过量的甲醇(装置见下图)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
-
(1) 步骤1中,加入过量甲醇的目的是。
-
(2) 步骤2中,上图所示的装置中仪器A的名称是;蒸馏烧瓶中加入碎瓷片的目的是。
-
(3) 步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是;分离出有机相的操作名称为。
-
(4) 步骤4中,蒸馏时不能用水浴加热的原因是。
下列说法错误的是( )
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀pH | 8.7 | 4.7 | 3.2 | 9.0 |
②CaF2的溶解度小于CaC2O4
③NiSO4·7H2O易溶于水,难溶于乙醇
回答下列问题:
-
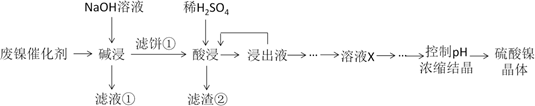
(1) “碱浸”中NaOH的作用分别是除去油脂、SiO2和。
-
(2) 由流程中的“浸出液”制备硫酸镍晶体的正确实验步骤是:
第1步:取“浸出液”, ,充分反应后过滤,以除去铁元素;
第2步:向所得滤液中,充分反应后过滤,得“溶液X”;
第3步:,充分反应后过滤;
第4步:滤渣用,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
a.加入适量(NH4)2C2O4
b.加入适量NH4F溶液
c.调节滤液的pH>8.7
d.加入足量的H2O2 , 调节溶液pH为3.2~7.2
e.加入足量的氯水,调节溶液pH为3.2~7.2
f.用稍过量硫酸充分溶解后
-
(3) 下列说法错误的是______A . 快速冷却溶液,可以得到细小的晶体颗粒 B . 滤饼①中主要含有Fe、Ni两种金属单质 C . 碱浸后抽滤得到滤饼①,该操作过程中需先微开水龙头,让滤纸紧贴布氏漏斗上 D . 将分离出硫酸镍晶体后的母液收集、循环使用,其意义是提高镍的回收率
-
(4) 将得到的硫酸镍晶体溶解后加入(NH4)2C2O4进行“沉镍”工序,得到的混合物过滤,用乙醇洗涤、110℃下烘干,得到NiC2O4·2H2O ,实验测定产品中NiC2O4·2H2O含量为100.8%,NiC2O4·2H2O产品中可能混有的物质是 。
①在催化剂存在下生成丙烯腈(C3H3N)的热化学方程式为C3H6(g)+NH3(g)+3/2O2(g)=C3H3N(g)+3H2O(g) ΔH=-515 kJ/mol
②得到副产物丙烯醛(C3H4O)的热化学方程式为C3H6(g)+O2(g)=C3H4O(g)+H2O(g) ΔH=-353kJ/mol
丙烯腈产率与反应温度的关系曲线如图所示。
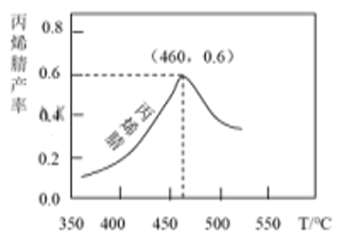
下列说法错误的是( )
 B . 增大压强可以提高丙烯腈的平衡产率
C . 温度低于460℃时,丙烯腈的产率不是对应温度下的平衡产率
D . C3H4O(g)+NH3(g)+
B . 增大压强可以提高丙烯腈的平衡产率
C . 温度低于460℃时,丙烯腈的产率不是对应温度下的平衡产率
D . C3H4O(g)+NH3(g)+  O2(g)=C3H3N(g)+2H2O(g) ΔH=-162 kJ/mol
O2(g)=C3H3N(g)+2H2O(g) ΔH=-162 kJ/mol
| 选项 | 混合物 | 除杂试剂 | 方法 |
| A | 乙醇(乙酸) | CaO | 蒸馏 |
| B | 乙烯(二氧化硫) | 酸性高锰酸钾溶液 | 洗气 |
| C | 溴苯(溴) | KI溶液 | 分液 |
| D | 乙烷(C2H4) | 氢气 | 催化加热 |
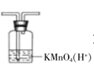 B . 石油分馏
B . 石油分馏 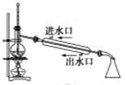 C . 实验室制硝基苯
C . 实验室制硝基苯 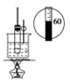 D . 实验室制乙酸乙酯
D . 实验室制乙酸乙酯 
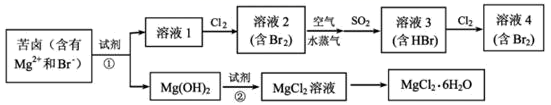
-
(1) 写出一种海水淡化的方法:。
-
(2) 用电子式表示 MgCl2的形成过程: 。
-
(3) 工业上用MgCl2 制取 Mg 一般常用的方法是________。A . 电解法 B . 还原剂还原法 C . 热分解法 D . 铝热法
-
(4) 提取溴的过程中,经过2次Br-⟶Br2转化的目的是 。
-
(5) 反应①,SO2被Br2氧化为
 ,则该反应中消耗的n(SO2):n(Br2)=;反应②的离子方程式为 。
,则该反应中消耗的n(SO2):n(Br2)=;反应②的离子方程式为 。
-
(6) 用下面提供的试剂,设计简单的实验证明Br 的非金属性比 I 强。(已知Br2 和I2溶在水中浓度较稀时都呈黄色)。。(可选择的试剂:溴水、碘水、KI 溶液、四氯化碳、氯水、淀粉溶液。)

已知:镍的萃取、反萃过程反应为 
-
(1) 检验酸浸滤液中含Fe2+的试剂为。
-
(2) “电解”过程,阴极的电极反应式为。
-
(3) 滤渣②主要成分为AlPO4、FePO4、CrPO4不同电解电压、电解时间下Fe2+、Cr4+离子的检测结果如下表所示,电解酸浸滤液的最佳电压和时间分别是。
电解电压(V)
1.0
1.5
2.0
2.5
3.0
Fe2+
有
有
有
无
无
Cr4+
无
无
无
无
有
电解时间(h)
2.6
3.1
3.6
4.1
4.6
Fe2+
有
无
无
无
无
Cr4+
无
无
有
有
有
-
(4) “沉淀”后,溶液中c(
 )=4.0×10-9mol·L-1 , 则c(Al3+)=。(已知:Ksp(AlPO4)=9.84×10-21)
)=4.0×10-9mol·L-1 , 则c(Al3+)=。(已知:Ksp(AlPO4)=9.84×10-21)
-
(5) “反萃”中,加入的X是。
-
(6) 为测定硫酸镍晶体(NiSO4·nH2O)组成,进行如下实验:取5.260g样品,配成250mL溶液,量取25.00mL溶液,用0.100mol·L-1的EDTA(Na2H2Y)标准液滴定(反应为Ni2++H2Y2-=NiY2-+2H+)。重复滴定3次,平均消耗EDTA标准液20.00mL,则硫酸镍的化学式为。
 )是高性能磁性材料,广泛用于电子工业,也用于化工、医药等行业。以某矿物加工过程中产生的滤渣(主要成分为
)是高性能磁性材料,广泛用于电子工业,也用于化工、医药等行业。以某矿物加工过程中产生的滤渣(主要成分为  、
、  含少量
含少量  )为原料制备
)为原料制备  的流程如图:
的流程如图: 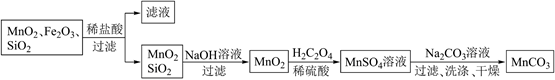
回答下列问题:
-
(1) 锰、铁在元素周期表中均属于(填标号)。
a.短周期元素b.第四周期元素c.副族元素d.过渡元素
-
(2) 上述流程中的滤液经蒸干、灼烧可得到副产品,其化学式为。
-
(3) 写出
 转化为
转化为  这一反应的离子方程式为。
这一反应的离子方程式为。
-
(4) 已知:25℃,
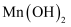 的
的 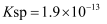 。若
。若  溶液的浓度为1.9mol/L,制备
溶液的浓度为1.9mol/L,制备 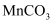 时为避免沉淀中混有
时为避免沉淀中混有 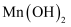 ,需控制溶液的pH不超过。
,需控制溶液的pH不超过。
-
(5)
 溶液和
溶液和  溶液混合产生
溶液混合产生 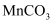 的沉淀,经过过滤、洗涤、干燥可获得
的沉淀,经过过滤、洗涤、干燥可获得 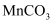 过滤时需要用到的玻璃仪器有:烧杯、。请你简述证明沉淀洗涤干净的操作方法:。
过滤时需要用到的玻璃仪器有:烧杯、。请你简述证明沉淀洗涤干净的操作方法:。
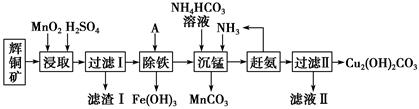
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
-
(1) 加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有(任写一种)。
-
(2) 滤渣I中的主要成分是MnO2、S、SiO2 , 请写出“浸取”反应中生成S的化学方程式:。
-
(3) 常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为,若加 A 后溶液的 pH调为4.0,则溶液中 Fe3+的浓度为mol/L。
-
(4) 写出“沉锰”(除 Mn2+)过程中反应的离子方程式:。
-
(5) “赶氨”时,最适宜的操作方法是。
-
(6) 过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是。

回答下列问题:
-
(1) 仪器X名称是,甲装置圆底烧瓶中的试剂为K2Cr2O7固体,写出发生反应的离子方程式。
-
(2) 为达成实验目的,上述仪器口连接顺序依次为:a-。
-
(3) 丁装置中所盛试剂为;乙装置中采用冰水浴冷却的目的是。
-
(4) 反应结束,取出b中试管,经冷却结晶,,,干燥,得到KClO3晶体。
-
(5) 为进一步测定所得KClO3晶体的纯度,设计了如下实验方案:

写出通入足量SO2时,溶液中发生反应的离子方程式。依据上述实验结果,测得该晶体的纯度为。
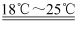 HgCl2+Cl2O。下列有关该实验的说法错误的是( )
HgCl2+Cl2O。下列有关该实验的说法错误的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向FeI2溶液中通入少量Cl2 | 溶液变黄 | Cl2的氧化性强于Fe3+ |
B | 向NaCl、NaBr的混合稀溶液中滴入少量稀AgNO3溶液 | 有浅黄色 沉淀生成 | Ksp(AgCl) > Ksp(AgBr) |
C | 常温下,向NaHS溶液中滴加石蕊试液 | 溶液变蓝 | Kw>Ka1(H2S)·Ka2(H2S) |
D | 向盛有2 mL一定浓度的Na3 [Ag(S2O3)2] 溶液的试管中,滴入5滴2 mol· L-1KI溶液 | 产生黄色沉淀 | [Ag(S2O3)2]3- 能够完全电离 |
-
(1) 现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。
①甲同学的操作是:取一小烧杯,加入40mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
②乙向饱和FeCl3溶液直接加入过量的NaOH溶液。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法正确:(填“甲”、“乙”或“丙”),发生的化学反应方程式是。
-
(2) 用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论。
-
(3) Fe(OH)3胶体稳定存在的主要原因是。
-
(4) 下列说法中属于Fe(OH)3胶体区别于FeCl3溶液的选项共有____个(填阿拉伯数字)。A . 分散质Fe(OH)3胶体粒子的直径在1~100nm之间 B . Fe(OH)3胶体具有丁达尔效应 C . Fe(OH)3胶体是均一稳定的分散系 D . 分散质Fe(OH)3胶体粒子能透过滤纸 E . Fe(OH)3胶体为红褐色透明状液体



