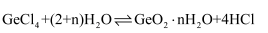课题一 物质的分离和提纯 知识点题库
①分液 ②蒸馏 ③过滤 ④盐析 ⑤渗析

-
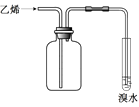
(1) 装置A中仪器①的名称是,装置D中仪器②的名称是.
-
(2) 从氯化钾溶液中得到氯化钾固体,应选择装置(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置;从碘水中分离出I2 , 选择装置,该装置的主要仪器名称是.
编号 | A | B | C | D |
实验 方案 |
|
|
|
|
实验 目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
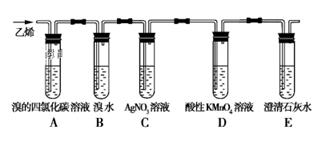
根据上述装置,回答下列问题:
-
(1) C装置的作用是。
-
(2) 已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。预测:A装置中的现象是,B装置中的现象是。分离A装置中产物的操作名称是,分离B装置中产物需要的玻璃仪器名称是。
-
(3) D装置中溶液由紫色变无色,D装置中发生反应的类型为。
-
(4) 写出A装置中发生反应的化学方程式,反应类型为,E装置的作用是。
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③乙烯(SO2)通过盛有溴水的洗气瓶
④乙醇中少量的乙酸:加足量生石灰,蒸馏。
知Fe3+在浓盐酸中生成黄色配离子(FeCl4),该配离子在乙醚(Et2O,沸点34.6℃)中生成缔合物  。下列说法错误的是( )
。下列说法错误的是( )

-
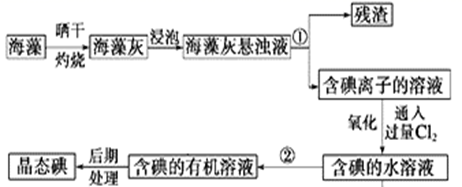
(1) 指出提取碘的过程中有关实验操作①和②的名称:;。
-
(2) 在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象是图中的(注:试管中深色区为有色溶液),上层无色溶液的溶质是:,下层颜色是。
-
(3) 含碘离子的溶液中通入过量的Cl2发生的离子方程式为。
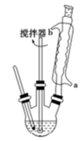
反应原理:
![]() +2KMnO4→
+2KMnO4→ 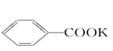 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→ ![]() +KCl
+KCl
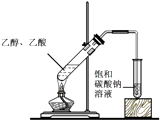
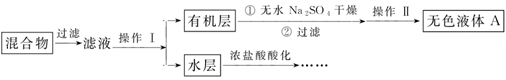
实验方法:将一定量的甲苯和KMnO4溶液置于三颈烧瓶中,在90℃时反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。
-
(1) 无色液体A的结构简式为,操作Ⅱ为;
-
(2) 如果滤液呈紫色,要先加饱和亚硫酸钾溶液,过滤后再进行操作Ⅰ。加饱和亚硫酸钾溶液的目的是,写出该反应的离子方程式:;
-
(3) 冷却水应该从冷凝管(填“a”或“b”)口流入;
-
(4) 要由“水层”得到苯甲酸晶体,应进行下列操作,正确的操作顺序是___(填选项字母):A . 酸化 B . 过滤 C . 蒸发浓缩 D . 冷却结晶
-
(5) 纯度测定:称取1.22g产品,配成100mL溶液,取其中25.00mL溶液,用KOH溶液进行滴定,消耗KOH的物质的量为2.40×10-3mol,则产品中苯甲酸的质量分数为__。
 溶液,形成带电的胶体,导电能力增强
B . 葡萄酒中添加适量
溶液,形成带电的胶体,导电能力增强
B . 葡萄酒中添加适量  ,可以起到抗氧化和漂白的作用
C . 工业废水中的
,可以起到抗氧化和漂白的作用
C . 工业废水中的  、
、  等重金属离子可以通过加适量
等重金属离子可以通过加适量 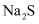 除去
D . 工业燃烧煤时,加入少量石灰石可减少温室气体的排放
除去
D . 工业燃烧煤时,加入少量石灰石可减少温室气体的排放
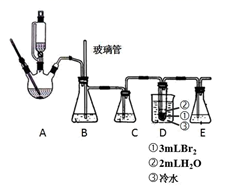
已知:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
回答下列问题
-
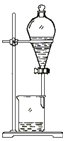
(1) 组装仪器后进行该实验前必须进行的操作是。
-
(2) 装置B的作用是。
-
(3) 在装置 C 中最佳加入试剂为,C内发生的主要反应的离子方程式为。
-
(4) 装置D中发生主要反应的化学方程式为。
-
(5) 反应过程中应用冷水冷却装置D,其主要目的是;下列冷却剂合适的为
A 冰水混合物 B 5℃的水 C 10℃的水
-
(6) 判断反应结束的现象是。将 1,2-二溴乙烷粗产品 置于分液漏斗中加水,振荡后静置,产物应在层 ( 填“上”或“下” )
-
(7) 在装置 E 中应加入,作用是。
-
(8) 下列操作中,不会导致产物产率降低的是(填正确答案的标号)
a 乙烯通入溴水时速率太快 b 装置 C 中的溶液用水代替
c D 中试管内液溴上不加水 d 实验时没有 E 装置
 ℃,沸点为
℃,沸点为  ℃,微溶于水,易溶于乙醇。要从乙醇与乙醚的混合物中分离出乙醚,需要用到的仪器是( )
℃,微溶于水,易溶于乙醇。要从乙醇与乙醚的混合物中分离出乙醚,需要用到的仪器是( )
 C .
C . ①溴水②苯③铁丝④CCl4⑤AgNO3溶液⑥NaOH溶液⑦NaHSO3溶液⑧石蕊试液
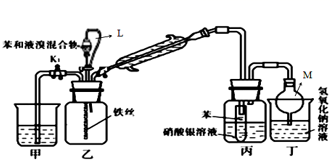
-
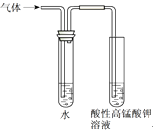
(1) 装置乙中发生反应的化学方程式为。
-
(2) 仪器M的名称是;装置丁的作用是。
-
(3) 橡胶管L的作用是__。
-
(4) 若用⑦代替丁中NaOH溶液,反应的离子方程式为。
-
(5) 如果实验室无液溴,能否用溴水代替?(填“能”或“否”)若不行,该如何利用本实验提供的试剂使实验成功?(若可行,此问不作答)
-
(6) 反应结束后打开K1使装置甲中的水倒吸入装置乙中,这样操作的目的是。

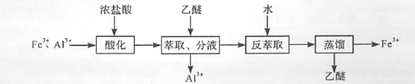
已知浸出时产生的废渣中有SiO2 , Fe(OH)3和Al(OH)3。下列说法错误的是( )

 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含  、
、  、
、  、
、 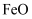 等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。 
已知:  不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于  溶液。
溶液。
回答下列问题:
-
(1) 废玻璃粉末与稀硫酸充分反应后,过滤要用到的玻璃仪器有玻璃棒、;“操作X”是将溶液1、过滤、洗涤、干燥得到硫酸铁铵晶体。
-
(2) 向滤液1中加入稀硫酸、
 溶液的目的是。滤渣1中加稀硫酸和溶液发生反应的离子方程式为。
溶液的目的是。滤渣1中加稀硫酸和溶液发生反应的离子方程式为。
-
(3) 要证明滤液1中含有
 ,可选用的试剂为。
,可选用的试剂为。
-
(4) 由滤液2生成
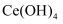 的离子方程式为。
的离子方程式为。
-
(5) 取上述流程中得到的
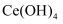 产品
产品  ,加硫酸溶解后,用浓度为
,加硫酸溶解后,用浓度为 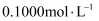 的
的 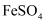 标准溶液滴定至终点时(铈元素被还原为
标准溶液滴定至终点时(铈元素被还原为  ),消耗
),消耗  标准溶液.该产品中
标准溶液.该产品中 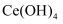 的质量分数为(结果保留两位有效数字)。
的质量分数为(结果保留两位有效数字)。
 是重要化工原料,由
是重要化工原料,由 制备
制备 的一种工艺流程如下:
的一种工艺流程如下:Ⅰ. 研磨 , 加水配成浊液。
, 加水配成浊液。
Ⅱ.  浊液经还原、纯化、制备等过程,最终获得
浊液经还原、纯化、制备等过程,最终获得 固体。
固体。

资料:① 不溶于水。该工艺条件下,
不溶于水。该工艺条件下, 与
与 不反应。
不反应。
②难溶电解质的溶度积: 、
、
-
(1) 研磨
 的目的是。
的目的是。
-
(2) 加入铁粉除去
 溶液中的
溶液中的 , 反应的离子方程式是。
, 反应的离子方程式是。
-
(3)
 氧化
氧化 的反应如下:
的反应如下: 
①根据上述反应,还原
 所需的
所需的 与
与 的物质的量比值应为2.而实际比值(1~1.25)小于2,原因是。
的物质的量比值应为2.而实际比值(1~1.25)小于2,原因是。②取少量母液,滴加
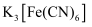 溶液,未产生蓝色沉淀,说明。
溶液,未产生蓝色沉淀,说明。 -
(4) 纯化
向母液中滴加氯水调
 , 除去残留的
, 除去残留的 。若母液中
。若母液中 , 使
, 使 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中 , 此时是否有
, 此时是否有 沉淀生成?(列式计算,已知
沉淀生成?(列式计算,已知 )。
)。 -
(5) 制备
将
 纯化液与稍过量的
纯化液与稍过量的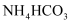 溶液混合,得到含
溶液混合,得到含 的浊液。将浊液过滤,洗涤沉淀,干燥后得到
的浊液。将浊液过滤,洗涤沉淀,干燥后得到 固体。
固体。①通过检验
 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 的操作是。
的操作是。②生成
 的离子方程式是。
的离子方程式是。
 和
和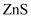 )制备高纯度锗的流程如图。已知:
)制备高纯度锗的流程如图。已知: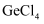 易水解,在浓盐酸中溶解度低。下列说法错误的是( )
易水解,在浓盐酸中溶解度低。下列说法错误的是( )