课题一 物质的分离和提纯 知识点题库

-
(1) 焙烧炉中反应为:2Al2(SO4)3+3S═2Al2O3+9SO2; 该反应的氧化剂及被氧化的元素分别是:;若生成1mol Al2O3 , 则转移电子数是个;
-
(2) 熟料溶解时的离子方程式:.
-
(3) 检验废渣中含有Fe2O3所需的试剂:.所观察到的现象为
-
(4) 母液中溶质的主要成分的化学式为:;溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀洗涤干净的实验操作和现象是:.
海水是巨大的资源宝库,海水的综合利用具有重要意义(如下图)

-
(1) 氯碱工业主要以食盐为原料,为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作:①加过量的NaOH溶液;②加过量的BaCl2溶液③加过量的Na2CO3溶液;④过滤;⑤加适量的盐酸,第③步操作的目的是
-
(2) 在实验室可以用萃取的方法提取溴,在萃取操作过程中,下列说法不正确的是 .A . 萃取剂可选用苯、CCl4、裂化汽油等有机溶剂. B . 萃取分液时下层液体从下口放出,上层液体从上口倒出 C . 在萃取过程中,需要振荡分液漏斗,并打开分液漏斗上口的玻璃塞放气.
-
(3) 通入热空气吹出溴,并用SO2的水溶液吸收的目的是.
-
(4) 步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是.
-
(5) 步骤Ⅲ中有关反应的离子方程式,解释该反应能够发生的原因.
-
(6) 海水提溴蒸馏过程中,温度应控制在80﹣90℃,温度过高或过低都不利于生产,请解释原因.
-
(7) 工业上不用电解熔融MgO制金属镁,理由是.

请回答:
-
(1) 步骤①和②的操作名称是.
-
(2) 步骤③判断加入盐酸“适量”的方法是;
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止,当蒸发皿中有较多量固体出现时,应,用余热使水分蒸干.
-
(3) 猜想和验证:
猜想
验证的方法
现象
结论
猜想Ⅰ:固体A中含
CaCO3、MgCO3
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口
猜想Ⅰ成立
猜想Ⅱ:固体A中含
BaCO3
取少量固体A于试管中,先滴入,再滴入Na2SO4溶液
有气泡放出,无白色沉淀
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4
取少量NaCl晶体溶于试管中的蒸馏水,
猜想Ⅲ成立
①乙烷(乙烯) 光照条件下通入Cl2 , 气液分离
②乙酸乙酯(乙酸) 用饱和碳酸钠溶液洗涤、分液
③苯(苯酚) 用氢氧化钠溶液洗涤、分液
④乙醇(水) 加足量生石灰、蒸馏.
3,5−二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5—二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) /g·cm—3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5—二甲氧基苯酚 |
| 33~36 |
| 易溶于甲醇、乙醚,微溶于水 |
-
(1) 反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是。
②萃取时使用的主要仪器为。分离出该容器中的有机层的操作是。
-
(2) 分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是。
-
(3) 洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是(填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
-
(4) 固液分离常采用减压过滤。减压过滤完成后应先拆去连接抽气泵和吸滤瓶的橡皮管再关闭抽气泵,其目的是。
选项 | 物质(括号内为杂质) | 除杂试剂 | 检验方法 |
A | CO2(SO2) | 饱和NaHSO3溶液 | 将已除杂质的少量气体通入品红溶液 |
B | NaHCO3溶液(Na2CO3) | 过量CO2 | 取少量溶液,加入Ca (OH)2溶液,观察现象 |
C | NO(NO2) | 水 | 观察颜色 |
D | 乙烷(乙烯) | 酸性KMnO4溶液 | 将已除杂质的少量气体通入溴水 |

 中含有的少量
中含有的少量  B . 用图b所示装置蒸干NH4Cl 饱和溶液制备
B . 用图b所示装置蒸干NH4Cl 饱和溶液制备  晶体
C . 用图c所示装置制取少量纯净的
晶体
C . 用图c所示装置制取少量纯净的  气体
D . 用图d所示装置分离
气体
D . 用图d所示装置分离  萃取碘水后已分层的有机层和水层
萃取碘水后已分层的有机层和水层
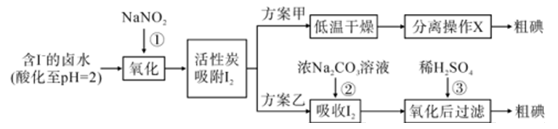
资料显示:
I.pH=2时,NaNO2溶液只能将I- 氧化为I2 , 同时生成 NO
II. I2+5Cl2+6H2O = 2HIO3+10HCl,5  +2
+2  +2H+ = I2+5
+2H+ = I2+5  +H2O
+H2O
-
(1) 反应①的离子方程式。
-
(2) 方案甲中,根据I2的特性,分离操作 X 的方法是。
-
(3) 已知:反应②中每吸收3molI2转移5mol电子,离子方程式是。
-
(4) Cl2、酸性 KMnO4 等都是常用的强氧化剂,但该工艺中氧化卤水中的I- 却选择了价格较高的NaNO2 , 原因是。
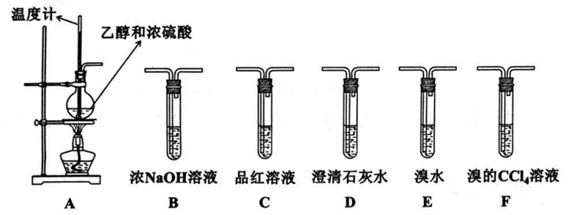
-
(1) A中发生反应的化学方程式为:.
-
(2) 加热混合液时,应迅速升温,否则会产生副产物(写结构简式).
-
(3) 若温度过高或加热时间过长,制得的乙烯中往往混有
 和
和  (假设不含其它杂质).为了确定气体的成分,请用上面给出的实验装置完成下列探究:
(假设不含其它杂质).为了确定气体的成分,请用上面给出的实验装置完成下列探究: ①若要证明混合气体中存在乙烯,可将混合气体依次通过
 ,则装置B的作用是,也可以直接将气体通入中(填装置代号,下同);
,则装置B的作用是,也可以直接将气体通入中(填装置代号,下同);②若要证明混合气体中存在
 ,可以将混合气体通入中
,可以将混合气体通入中③若要证明混合气体中存在
 ,则装置的连接顺序为→→D;
,则装置的连接顺序为→→D;④若要一次性将乙烯、
 、
、  全部检验出来,气体被检验的先后顺序为.
全部检验出来,气体被检验的先后顺序为.

滤液3经过多次萃取与反萃取制备CoCl2晶体。
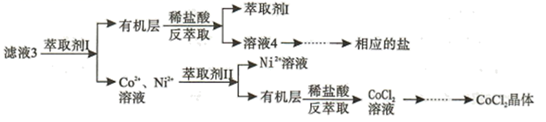
已知:
①焦亚硫酸钠Na2S2O5 , 常做食品抗氧化剂。MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
| Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mg2+ | |
| 开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 9.6 |
| 完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 11.1 |
请回答:
-
(1) 实验室中进行操作①时所需的玻璃仪器有。滤渣1的主要成分是。
-
(2) 取时加入Na2S2O5发生的氧化还原反应的离子方程式为。
-
(3) 滤液1中加入NaClO3的作用为。加入Na2CO3溶液发生反应的离子方程式为。
-
(4) 滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是。
-
(5) 制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是。
-
(6) 某学习小组同学为测定产品中CoCl2·6H2O晶体的纯度,将一定量的样品溶于水,再向其中加入足量AgNO3溶液,过滤洗涤,并将沉淀烘干后称量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是。(写一条即可)。
 B .
B .  C .
C .  D .
D . 
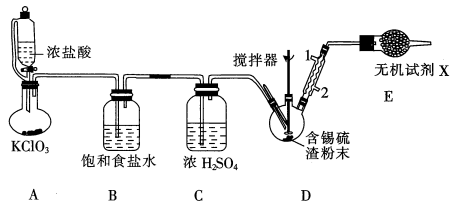
已知:①无水四氯化锡的熔点为-33℃、沸点为114.1℃;②四氯化锡易水解。下列说法正确的是( )



