课题一 物质的分离和提纯 知识点题库
用一种只有水分子能自由通过而直径较大的溶质分子不能通过的隔膜把水槽隔离成大小完全相同的甲、乙两室,甲室中装入淀粉溶液,乙室中装入蒸馏水(如图)。此时甲、乙两室中的水分子均可自由地通过隔膜而相互扩散,已知这种扩散速度与单位体积内溶质的微粒数成反比,而与液体的压强成正比。

根据以上叙述回答下列问题:
①若甲、乙两室中装入液体的体积相同,对于实验开始阶段的描述正确的是。
A.水分子从甲室向乙室的扩散速度大于乙室向甲室的扩散速度
B.水分子从乙室向甲室的扩散速度大于甲室向乙室的扩散速度
C.两室中水分子的相互扩散速度相等
D.两室中水分子的扩散速度将越来越小
②相同温度下,甲室装入质量分数为1%的尿素[CO(NH2)2]水溶液,乙室装入等体积的质量分数为a%的葡萄糖(C6H12O6)溶液,若两溶液的密度近似看成1g·cm-3 , 且水分子相互扩散的速度也相等,则a的近似值是。
A.1 B.2 C.3 D.4
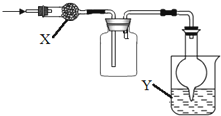
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
选项 | X | 收集气体 | Y |
A | 碱石灰 | 氯气 | 氢氧化钠 |
B | 碱石灰 | 氨气 | 水 |
C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
D | 氯化钙 | 一氧化氮 | 氢氧化钠 |

-
(1) 写出滤液A中加入足量硫酸后所发生反应的离子方程式:.
-
(2) 已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全.下列物质中可用作调整溶液C的pH的试剂是 (填序号).A . 铜粉 B . 氨水 C . 氢氧化铜 D . 碳酸铜
-
(3) 常温,若溶液C中金属离子均为1mol•L﹣1 , Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Cu(OH)2]=2.2×10﹣20 . 控制pH=4,溶液中c(Fe3+)=,此时 Cu(OH)2沉淀生成(填“有”或“无”).
-
(4) 将20mLAl2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80mL混合,反应的离子方程式为.

-
(1) 请列举海水淡化的两种方法:、.
-
(2) 步骤I中己获得Br2 , 步骤II中又将Br2还原为Br﹣ . 其目的是.
-
(3) 步骤II用SO2水溶液吸收Br2 , 吸收率可达95%.有关反应的离子方程式为.
-
(4) 某化学研究性学习小组为了了解从工业溴中提纯溴的方法.查阅了有关资料知:Br2的沸点为59℃.微溶于水,有毒并有强腐蚀性.他们参观生产过程后.画了如图2装置简图:

请你参与分析讨论:
①图中仪器B的名称是.
②整套实验装皿中仪器连接均不能用橡胶塞和橡胶管.其原因是.
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?.
④C中液体颜色为.为除去该产物中仍残留的少量Cl2 , 可向其中加入NaBr,溶液,充分反应后.再进行的分离操作是.
选项 | 异常情况 | 可能原因分析 |
A | 蒸发结晶:蒸发皿破裂 | 将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
B | 分液:分液漏斗中的液体难以滴下 | 没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
C | 萃取:液体静置不分层 | 加入萃取剂的量较多 |
D | 蒸馏:冷凝管破裂 | 冷凝管没有通水或先加热后通水 |
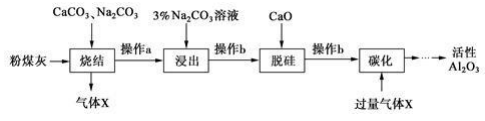
已知烧结过程的产物主要是NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
-
(1) 写出烧结过程中铝元素转化的化学方程式。
-
(2) 操作 a 为冷却、研磨,其中研磨的目的是。
-
(3) ①浸出过程中, NaFeO 2 可完全水解,生成沉淀为。
②3%Na2 CO3溶液显(填 “酸性 ”、 “碱性 ”或“中性 ”),请用离子方程式解释:。
-
(4) 操作b 所用的玻璃仪器有漏斗、、。
-
(5) “碳化”时,通入过量气体 x 主要成分的化学式为。
-
(6) 工业上电解Al2O3制备 Al 是为使Al2O3在较低温下融化,通常加入。电解过程中做阳极的石墨易消耗,原因是。
-
(1) 海水淡化的方法有(选填一种即可)。
-
(2) 从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是。
-
(3) 下图是从海水中提取镁的简单流程。

工业上常用于沉淀Mg2+的试剂A 的俗名是,Mg(OH)2转化为MgCl2 的离子方程式是。
-
(4) 海带灰中富含以I-形式存在的碘元素。实验室提取I2 的途径如下所示:
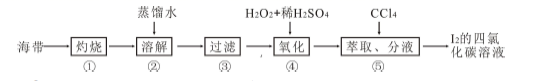
①灼烧海带至灰烬时所用的主要仪器名称是。步骤②加热煮沸一会的目的是。
② 步骤④向滤液中加H2O2 和稀H2SO4 溶液,写出该反应的离子方程式。反应结束后,再加入CCl4 作萃取剂,振荡、静置,可以观察到CCl4 层呈色。
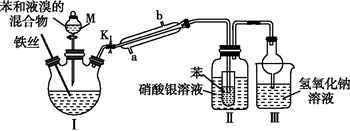
请回答下列问题:
-
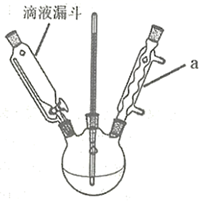
(1) 仪器M的名称为。
-
(2) 装置Ⅰ中生成溴苯的化学方程式为。
-
(3) 冷凝管的进水口为(填“a”或“b”);其作用是。
-
(4) 能验证苯与液溴发生的是取代反应的现象是。
-
(5) 装置Ⅱ中,若撤去装有苯的小试管,将导管直接插入硝酸银溶液,对实验目的达成会产生什么影响?。
-
(6) 装置Ⅲ中的离子反应方程式为。
 的条件下将
的条件下将 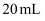 的苯(相对分子质量为78,密度为
的苯(相对分子质量为78,密度为  )与
)与  浓硫酸和
浓硫酸和 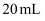 浓硝酸的混合液共热来制备硝基苯(相对分子质量为123,难溶于水的油状液体),制备原理和装置示意图(加热和夹持装置省略)如下:
浓硝酸的混合液共热来制备硝基苯(相对分子质量为123,难溶于水的油状液体),制备原理和装置示意图(加热和夹持装置省略)如下: ![]() +HNO3
+HNO3 
![]() +H2O
+H2O
查阅资料可知反应机理如下:
① 
② ![]() +
+ 

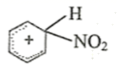
③……………
回答下列问题:
-
(1) 中间产物
 的分子构型是。
的分子构型是。
-
(2) 中间体正离子(
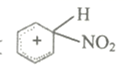 )中与硝基相连的碳原子的杂化方式是。
)中与硝基相连的碳原子的杂化方式是。
-
(3) 请完成第③步反应: 。
-
(4) 该实验采用恒温加热,为控制反应温度,可采用加热的方法。仪器a的名称是。
-
(5) 混合浓硫酸和浓硝酸的操作是往装有浓硝酸的烧杯中加入浓硫酸并不断搅拌,此操作的原因是。
-
(6) 反应结束后,冷却反应混合物,分离出有机层,所得物质中除硝基苯外还含有硝酸、硫酸、苯、苯磺酸等,依次用蒸馏水、
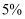 的
的  溶液和蒸馏水洗涤,再用无水
溶液和蒸馏水洗涤,再用无水  干燥后,得到粗硝基苯。有机层用
干燥后,得到粗硝基苯。有机层用 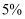 的
的  溶液洗涤的目的是。
溶液洗涤的目的是。
-
(7) 若该实验制备得到纯硝基苯
 ,则该实验中硝基苯的产率是。(保留小数点后两位)
,则该实验中硝基苯的产率是。(保留小数点后两位)
![]() 已知:①I2(s)+I-(aq)
已知:①I2(s)+I-(aq)  I
I  (aq)。
(aq)。
②水合肼(N2H4·H2O)具有强还原性,可将各种价态的碘还原为I- , 氧化产物为N2。
③NaI易被氧化,易溶于水、酒精,在酒精中的溶解度随温度的升高增加不大。
回答下列问题:
-
(1) ①步骤Ⅰ,I2与Na2CO3溶液同时发生两个反应,生成物除NaI外,还分别生成NaIO和NaIO3 , 一个反应为:I2+Na2CO3=NaI+NaIO+CO2↑,另一个反应为:。
②I2与Na2CO3溶液的反应很慢,加入NaI固体能使开始反应时的速率明显加快,原因可能是。
-
(2) 步骤Ⅱ,水合肼与IO
 反应的离子方程式为。
反应的离子方程式为。
-
(3) 步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH时依次加入的试剂为、、。
A.NaOH B.HI C.NH3•H2O D.高纯水
-
(4) 步骤Ⅳ,蒸发操作为减压蒸发。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有。
A.直形冷凝管
 B.球形冷凝管
B.球形冷凝管 
C.烧杯
 D.抽气泵
D.抽气泵 
②采用“减压蒸发”的优点有:减小压强,降低沸点,利于水的蒸发;。
-
(5) 将制备的NaI•2H2O粗品以无水乙醇为溶剂进行重结晶。请选择合理的操作并排序:加热乙醇→→→→→纯品(选填序号)。
①高纯水洗涤 ②减压蒸发结晶 ③真空干燥 ④NaI•2H2O粗品溶解 ⑤趁热过滤 ⑥降温结晶
 )可用于制作发光电子组件。以铜镉废渣(含
)可用于制作发光电子组件。以铜镉废渣(含  、
、  、
、  、
、  等单质)为原料制备镉的工艺流程如下:
等单质)为原料制备镉的工艺流程如下: 
浸出后的溶液中含有 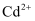 、
、  、
、  等金属离子,相关金属离子形成氢氧化物沉淀的
等金属离子,相关金属离子形成氢氧化物沉淀的  (开始沉淀的
(开始沉淀的  按金属离子浓度为
按金属离子浓度为  计算)如下表:
计算)如下表:
| 氢氧化物 | | | |
| 开始沉淀的 | 1.5 | 5.9 | 7.2 |
| 沉淀完全的 | 3.3 | 8.9 | 9.9 |
-
(1) “浸出”时通入氮气而不是通入空气进行搅拌的原因是。
-
(2) “氧化”时发生反应的离子方程式为。
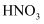 也能氧化
也能氧化  ,工业生产中不选用
,工业生产中不选用 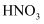 的原因是。
的原因是。
-
(3) “调
 ”时控制溶液
”时控制溶液  在3.3~5.9之间,“滤渣”的主要成分是(填化学式)。
在3.3~5.9之间,“滤渣”的主要成分是(填化学式)。
-
(4) “置换”时发生的反应为
 。
。 镉置换率
 与
与  的关系如题图所示。实际生产中选择
的关系如题图所示。实际生产中选择  的原因是。
的原因是。
-
(5)
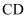 和
和 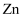 同族且相邻,部分金属水合离子的颜色如下表所示:
同族且相邻,部分金属水合离子的颜色如下表所示: 离子





颜色
浅绿色
蓝色
无色
无色
无色
①金属水合离子是否有颜色与金属离子的结构间的关系可描述为。
②硫酸酸化的硫酸铁溶液中铁元素以
 形式存在而使溶液呈浅紫色,向其中滴入几滴
形式存在而使溶液呈浅紫色,向其中滴入几滴 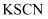 溶液,因生成
溶液,因生成  、
、  等离子而使溶液呈红色,能发生上述反应的原因是。
等离子而使溶液呈红色,能发生上述反应的原因是。
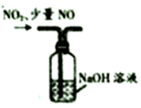
| 选项 | A | B | C | D |
| 实验装置 | | | | |
| 实验目的 | 用坩埚灼烧除去高锰酸钾中的氯化铵 | 实验室制备干燥纯净的氯气 | 分离甘油和水 | 尾气处理混有少量 |

请回答下列问题:
-
(1) 仪器A的名称为,操作A为。
-
(2) 煮沸的作用是。
-
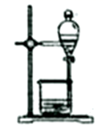
(3) 步骤X中,使用了分液漏斗。分液漏斗使用前,须进行的操作是;萃取后,分液漏斗内观察到的现象是。
-
(4) 向海带浸取原液中通入适量
 , 并控制溶液pH为4.5,此时发生反应的离子方程为。
, 并控制溶液pH为4.5,此时发生反应的离子方程为。
-
(5) 步骤Y中发生反应的离子方程式为。
-
(6) 该实验流程中,能循环使用的物质是。
A.调酱 | B.煮面 | C.捞面 | D.拌面 |
|
|
|
|





 的
的  气体
气体






