实验3-1 几种无机离子的检验 知识点题库

图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
-
(1) 物质X可以是,C是,F是.
-
(2) 反应①的化学方程式是,反应②的化学方程式是

-
(1) 滤渣A是,滤渣B是.
-
(2) 过程 I、II、III的分离操作的名称是.
-
(3) 过程 IV中灼烧时盛放药品的仪器名称是,发生反应的化学方程式是.
-
(4) 过程 III中发生反应生成滤渣C的离子方程式表示为.
-
(5) 取滤液B100mL,加入1molL﹣1盐酸200mL时,沉淀量达到最大且质量为11.7g.则溶液B中c(AlO2﹣)=,c(Na+)> mol•L﹣1 .
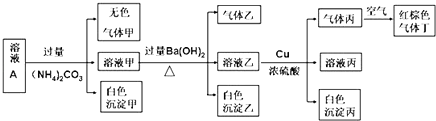
回答下列问题:
-
(1) 溶液A中一定不存在的阴离子有.
-
(2) 生成沉淀甲和沉淀乙的离子方程式分别为.
-
(3) 气体乙的结构式为.
-
(4) 生成气体丙的离子方程式为若实验消耗Cu 144g,则最多生成气体丁的体积(标准状况下)为.
 SiCl4
SiCl4  Si
B . Mg(OH)2
Si
B . Mg(OH)2  MgCl2(aq)
MgCl2(aq)  Mg
C . Fe2O3
Mg
C . Fe2O3  FeCl3(aq)
FeCl3(aq)  无水FeCl3
D . AgNO3(aq)
无水FeCl3
D . AgNO3(aq)  [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq)  Ag
Ag
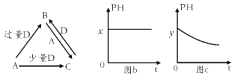
-
(1) 若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为.
-
(2) 若A为强碱,D为气态氧化物.常温时,将B的水溶液露置于空气中,其pH随时间 t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发).
①若图b符合事实,则D的化学式为;
②若图c符合事实,则其pH变化的原因是(用离子方程式表示)
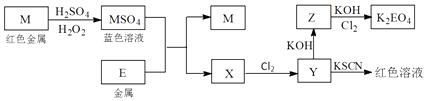
-
(1) 写出M溶于稀H2SO4和H2O2混合液的化学方程式:.
-
(2) 写出X生成Y的离子方程式:.
-
(3) 某同学取Y的溶液,酸化后加入KI淀粉溶液,溶液变为蓝色.写出与上述变化过程相关的离子方程式:.
-
(4) 写出将Cl2通入足量氢氧化钾溶液中反应的离子方程式:.
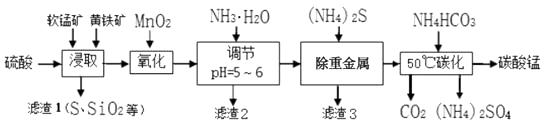
-
(1) 为了提高锰元素的浸出率,在“浸取”时可采取的措施有:
①适当升高温度,②搅拌,③等。
-
(2) 流程“氧化”中加入MnO2与Fe2+发生反应的离子方程式为。
-
(3) “滤渣2”中主要成分的化学式为。
-
(4) 流程“除重金属”时使用(NH4)2S而不使用Na2S的原因是。
-
(5) 流程“50℃碳化”得到碳酸锰,该反应的化学方程式为。
-
(6) 生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是。
-
(1) b的最小值为。
-
(2) 当b=时,产物中水的质量最多。
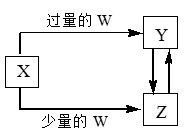
| 选项 | W | X |
| A | 盐酸 | 碳酸钠溶液 |
| B | 氢氧化钠溶液 | 氯化铝溶液 |
| C | 二氧化碳 | 氢氧化钙溶液 |
| D | 氯气 | 铁单质 |
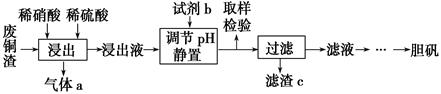
已知生成氢氧化物沉淀的pH如下表所示:
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀 | 4.2 | 6.5 | 1.5 |
| 完全沉淀 | 6.7 | 9.7 | 3.7 |
-
(1) 写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:。
-
(2) 取样检验是为了确认Fe3+是否除净,你的检验方法是。
-
(3) 试剂b是,滤渣c是(均写化学式)。
-
(4) 气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2=2NO2、。
-
(5) 一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:。
-
(6) 某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:。

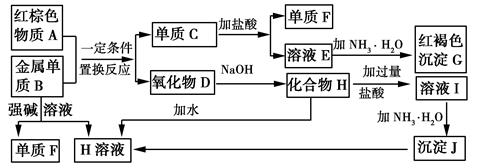
请回答下列问题:
-
(1) 物质A的化学式为。
-
(2) 写出单质B与强碱溶液反应的离子方程式,氧化物D与NaOH溶液反应的化学方程式。
-
(3) 溶液E中加入氨水时,先生成白色沉淀L,L最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
-
(4) 溶液E敞口放置容易变质,写出检验溶液E是否变质的实验操作、现象及结论,为了防止溶液E的变质,可往溶液中加入。
-
(5) 溶液I中所含金属离子是。

-
(1) 元素F在周期表中的位置是 。
-
(2) 元素C,D,E原子半径由大到小的顺序是 (填元素符号)。
-
(3) A、B、C的单质与氢气反应的难易程度由易到难的顺序是 (用单质的化学式表示)。
-
(4) 应用元素周期律和元素周期表的知识,写出D和E所形成的化合物的化学式 、(写2种)。
-
(5) D在B单质中燃烧生成的物质电子式为,氢原子与B原子以1:1结合的物质结构式为 。
-
(6) 根据氯、溴、碘单质间的置换反应,判断F的单质和E的最简单氢化物之间能否发生反应(填“能”或“不能”),若能则写出反应的化学方程式 。
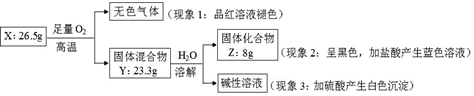
请回答:
-
(1) 由现象 1 得出化合物 X 含有元素(填元素符号),X 的化学式。
-
(2) 固体混合物 Y 的成分(填化学式)。
-
(3) 实验室常将氨气(NH3)通过红热的黑色固体化合物 Z 制备氮气,该反应的化学方程式是,当有28克氮气生成时转移的电子的物质的量为mol。
-
(1) Ⅰ.化合物Ⅹ由四种短周期元素组成,加热X,可产生使湿润的红色石蕊试纸变蓝的气体Y,Y为纯净物;取
 ,用含
,用含  的盐酸完全溶解得溶液A,将溶液A分成
的盐酸完全溶解得溶液A,将溶液A分成  和
和  两等份,完成如下实验(白色沉淀C可溶于
两等份,完成如下实验(白色沉淀C可溶于  溶液):
溶液):

请回答:
组成X的四种元素是N、H和(填元素符号),X的化学式是。
-
(2) 溶液B通入过量
 得到白色沉淀C的离子方程式是。
得到白色沉淀C的离子方程式是。
-
(3) 写出一个化合反应(用化学方程式或离子方程式表示)。要求同时满足:
①其中一种反应物的组成元素必须是X中除N、H外的两种元素;
②反应原理与“
 ”相同。
”相同。 -
(4) Ⅱ.某兴趣小组为验证浓硫酸的性质进行实验,如图。实验中观察到的现象有:锥形瓶内有白雾,烧杯中出现白色沉淀。请回答:
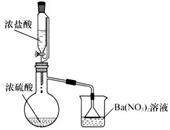
将浓硫酸和浓盐酸混合可产生
 气体的原因是。
气体的原因是。 -
(5) 烧杯中出现白色沉淀的原因是。
-
(1) 司南是由天然磁石制成的,其主要成分是(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
-
(2) 现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。
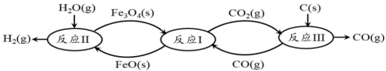
①已知:Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g)ΔH1=+19.3kJ·mol-1
3FeO(s)+CO2(g)ΔH1=+19.3kJ·mol-13FeO(s)+H2O(g)
 Fe3O4(s)+H2(g)ΔH2=-57.2kJ·mol-1
Fe3O4(s)+H2(g)ΔH2=-57.2kJ·mol-1C(s)+CO2(g)
 2CO(g)ΔH3=+172.4kJ·mol-1
2CO(g)ΔH3=+172.4kJ·mol-1铁氧化物循环裂解水制氢气总反应的热化学方程式是。
②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
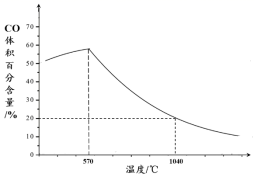
i.反应Fe3O4(s)+4CO(g)
 3Fe(s)+4CO2(g)ΔH0(填“>”、“<”或“=”),理由是。
3Fe(s)+4CO2(g)ΔH0(填“>”、“<”或“=”),理由是。ii.随温度升高,反应Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g)平衡常数的变化趋势是;1040℃时,该反应的化学平衡常数的数值是。
3FeO(s)+CO2(g)平衡常数的变化趋势是;1040℃时,该反应的化学平衡常数的数值是。 -
(3) ①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是。
②如今基于普鲁士蓝合成原理可检测食品中CN- , 方案如下:
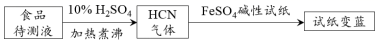
若试纸变蓝则证明食品中含有CN- , 请解释检测时试纸中FeSO4的作用。

-
(1) 化合物A的化学式:。
-
(2) 检验气体D的实验方法:。
-
(3) 写出B与H浓溶液反应的化学方程式:。
-
(4) 写出A在氧气中充分煅烧的化学方程式:。
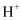 )=0.1mol∙L-1的溶液中:
)=0.1mol∙L-1的溶液中:  、
、  、
、  、
、  B .
B .  =10-12的溶液中:
=10-12的溶液中:  、
、  、
、  、
、  C . c(
C . c(  )=0.1mol∙L-1的溶液中:
)=0.1mol∙L-1的溶液中:  、
、  、
、  、
、  D . 加入KSCN显血红色的澄清透明溶液中:
D . 加入KSCN显血红色的澄清透明溶液中:  、
、  、
、  、
、 

请回答:
-
(1) 写出步骤Ⅰ反应的离子方程式:、。
-
(2) 试剂X是,溶液D是。
-
(3) 在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是。

-
(4) 由固体F制取硫酸铜溶液,通常有两种方案:
方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀硫酸中,然后不断鼓入空气。
方案一的缺点为:。
请写出方案二中发生反应的化学方程式:。

已知:B是空气的主要成分之一;A与H2O反应属于非氧化还原反应,且C是一种强碱;D遇湿润的红色石蕊试纸变蓝。
-
(1) X的组成元素为。
-
(2) B的组成元素在元素周期表中的位置是。
-
(3) 写出C的电子式为。
-
(4) X受热分解转变成A和B的化学方程式为。



