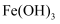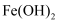实验3-1 几种无机离子的检验 知识点题库
如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,B为红棕色粉末,A、C为金属单质,I为黄绿色气体.请回答下列问题:

-
(1) B的化学式
-
(2) I的电子式
-
(3) A+B→C+D的化学方程
-
(4) F+C→E的离子方程式

-
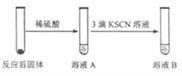
(1) 写出滤液A中加入足量硫酸后所发生反应的离子方程式:.
-
(2) 已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全.下列物质中可用作调整溶液C的pH的试剂是 (填序号).A . 铜粉 B . 氨水 C . 氢氧化铜 D . 碳酸铜
-
(3) 常温,若溶液C中金属离子均为1mol•L﹣1 , Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Cu(OH)2]=2.2×10﹣20 . 控制pH=4,溶液中c(Fe3+)=,此时 Cu(OH)2沉淀生成(填“有”或“无”).
-
(4) 将20mLAl2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80mL混合,反应的离子方程式为.

请填写下列空白:
-
(1) 在周期表中,组成单质G的元素位于第周期族.
-
(2) 在反应⑦中氧化剂与还原剂的物质的量之比为.
-
(3) 在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是.(填写序号)
-
(4) 反应④的离子方程式是:.
-
(5) 将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.该反应的化学方程式是:.


根据以上信息,回答下列问题:
-
(1) 溶液X中除H+外还肯定含有的离子是;
-
(2) 写出有关离子方程式:步骤①中生成A;步骤②生成沉淀I;
-
(3) 假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是.
回答下列问题:
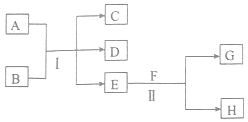
-
(1) F的化学式为,反应Ⅱ中每生成1molG,转移的电子数目为.
-
(2) 反应Ⅰ的化学方程式为.
-
(3) 除去D中混有的C气体,可选用(填字母).
a.氢氧化钠溶液 b.饱和碳酸氢钠溶液C.饱和碳酸钠溶液 d.酸性高锰酸钾溶液.

-
(1) E 的化学式为。
-
(2) K 的电子式为。
-
(3) 写出反应①的化学方程式。
-
(4) 写出反应②的离子方程式。
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
B | 浓硫酸具有脱水性和强氧化性 | 浓硫酸滴到湿润的蔗糖中,蔗糖变成黑色海绵状 |
C | SiO2有导电性 | SiO2可用于制备光导纤维 |
D | 饱和BaSO4溶液中加入饱和Na2CO3溶液有白色沉淀 | Ksp(BaSO4)<Ksp(BaCO3) |

-
(1) 若B为常见的碱性气体,C不溶于NaOH溶液。
①甲的电子式为。②写出A→B+C的化学方程式。
-
(2) 若B为具有臭鸡蛋气味的气体,乙与Fe2O3反应可用于焊接钢轨。
①工业上制取乙的化学方程式为。
②写出D溶液与过量氨水反应的离子方程式。

|
实验Ⅰ |
实验Ⅱ |
|
| |
请回答:
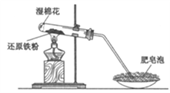
-
(1) 实验Ⅰ中湿棉花的作用是。
-
(2) 实验Ⅰ中反应的化学方程式是。
-
(3) 甲同学观察到实验Ⅰ中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有。
-
(4) 乙同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是。

已知:气体A为单质,标准状况下的密度为1.25g/L。请回答:
-
(1) 盐X的组成元素为H、O和(用元素符号表示)。
-
(2) 写出固体D和过量HI溶液反应的离子方程式。
-
(3) 写出盐X隔绝空气加热分解的化学方程式。
-
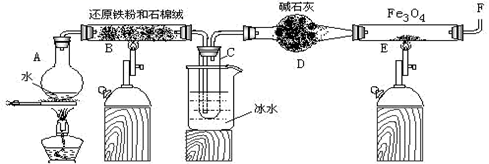
(1) 烧瓶A中常加入碎瓷片,其作用是,小试管C的作用是。
-
(2) 为了安全,在E管中的反应发生前,在F出口处必须,E管中的反应开始后,在F出口处应。
-
(3) 反应3Fe+4H2O(g)
 Fe3O4+4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释。
Fe3O4+4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释。
-
(4) 停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象。
-
(5) 若E管中反应按以下两步进行:Fe3O4+H2
 3FeO+H2O,FeO+H2
3FeO+H2O,FeO+H2  Fe+H2O,假设实验开始时E管中的Fe3O4为23.2 g,反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为20 g。通过计算分析其组成可能为(填序号)
Fe+H2O,假设实验开始时E管中的Fe3O4为23.2 g,反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为20 g。通过计算分析其组成可能为(填序号) ①Fe ②Fe和Fe3O4 ③FeO和Fe3O4 ④Fe和FeO ⑤Fe、FeO和Fe3O4
用此20 g固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉g。(不考虑空气中的成分参与反应)

回答下列问题:
-
(1) 实验室中利用丙制取甲的化学方程式为。
-
(2) 侯德榜法制碱时,在甲、戊、已的混合溶液中通入过量CO2 , 反应的化学方程式为;要从溶液中分离出产品,需进行的操作是。
-
(3) 工业上常用甲的浓溶液检测输送R气体的管道是否泄漏,该过程中反应的化学方程式为;若管道泄漏,观察到的现象是。
 晶体。具体的流程如下:
晶体。具体的流程如下: 
试回答下列问题:
-
(1) 提高“酸溶”的速率的方法是:。
-
(2) 蒸发过程中需要用到玻璃棒,此时玻璃棒的作用是。
-
(3) 过滤时,需要用到的玻璃仪器是:烧杯、、,过滤后所得滤渣的主要成分是:。
-
(4) “氧化”过程中发生反应的离子方程式为,该反应中氧化剂是。
-
(5) “氧化”过程结束后,如何证明溶液中有
 存在?请写出实验方案:。
存在?请写出实验方案:。
 是合成其他含钴配合物的重要原料,其工业制备过程如下:
是合成其他含钴配合物的重要原料,其工业制备过程如下:步骤Ⅰ:工业利用水钴矿(住要成分为 , 含少量
, 含少量 、
、 、
、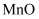 、
、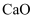 、
、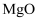 、
、 等)制取氯化钴晶体:
等)制取氯化钴晶体:
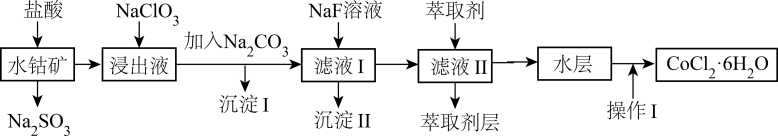
步骤Ⅱ:在活性炭的催化作用下,通过氧化 制得到
制得到 流程如下:
流程如下:
 已知:①氧化性:
已知:①氧化性:
②沉淀Ⅰ、沉淀Ⅱ中都只含有两种沉淀。
③以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 |
|
|
|
|
|
|
开始沉淀 | 2.7 | 4.0 | 7.6 | 7.7 | 9.6 | 7.5 |
完全沉淀 | 3.7 | 5.2 | 9.6 | 9.8 | 11.1 | 9.2 |
-
(1)
 原子的核外电子排布式为:。
原子的核外电子排布式为:。
-
(2) 加入
 的主要作用:。
的主要作用:。
-
(3) 向“浸出液”中加入适量的
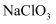 , 反应的离子方程式是,加入
, 反应的离子方程式是,加入 调节溶液
调节溶液 范围为:②;萃取剂层含锰元素,则加入
范围为:②;萃取剂层含锰元素,则加入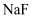 的作用是:③。
的作用是:③。
-
(4) 步骤Ⅱ中氧化过程,需水浴控温在
 , 温度不能过高,原因是:;“系列操作”是指在高浓度的盐酸中使
, 温度不能过高,原因是:;“系列操作”是指在高浓度的盐酸中使 结晶析出,过滤,醇洗,干燥。使用乙醇洗涤产品的具体操作是:。
结晶析出,过滤,醇洗,干燥。使用乙醇洗涤产品的具体操作是:。
-
(5) 结束后废水中的
 , 人们常用
, 人们常用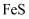 沉淀剂来处理,原理是(用离子方程式表示)。
沉淀剂来处理,原理是(用离子方程式表示)。

已知:I.难溶物的溶度积常数如表所示。
难溶物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Ni(OH)2 | Al(OH)3 | MnS | FeS | NiS |
溶度积常数(Ksp) | 4×10-38 | 2×10-16 | 2×10-13 | 2×10-16 | 1×10-33 | 1×10-15 | 6×10-18 | 1×10-24 |
II.溶液中离子浓度≤10-5mol·L-1时,认为该离子沉淀完全
回答下列问题:
-
(1) “化浆”时生成气体的电子式为。
-
(2) “吸收”时,浆液与含SO2废气通过逆流方式混合目的为;该过程中,MnO2发生反应的离子方程式为。
-
(3) “吸收”所得溶液中c(Fe2+)=0.04mol·L-1、c(Ni2+)=0.00017mol·L-1、c(Al3+)=0.001mol·L-1、c(Mn2+)=0.12mol·L-1 , 滤液1中c(Mn2+)=0.2mol·L-1、c(Ni2+)=0.0002mol·L-1 , 则“调pH”的范围为(溶液体积变化忽略不计,保留两位有效数字);从滤渣1中分离出Al(OH)3的方法为。
-
(4) “除镍”时,将Ni2+转化为NiS而不是Ni(OH)2的原因为。
-
(5) “转化"反应在pH=5的条件下进行,其主要反应中氧化剂与还原剂的物质的量之比为。