实验3-1 几种无机离子的检验 知识点题库
请回答下列问题:

-
(1) E在元素周期表中的位置是
-
(2) 上述元素形成的简单离子中,半径最小的是(填离子符号).
-
(3) 由上述元素中的一种或几种组成的物质甲可以发生如图1反应:
①若乙具有漂白性,则乙的电子式为.
②若丙的水溶液是强碱性溶液,则甲为或(填化学式).
③若乙为二元弱酸,丙既能溶于强酸、又能溶于强碱,则乙的名称为;用电离方程式表示丙既能溶于强酸、又能溶于强碱的原因.
④乙遇空气变为红棕色,有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确.用如图2装置进行实验时,分液漏斗中应加入(填试剂名称).实验过程中,浓硫酸中未发现有气体逸出,且溶液变为红棕色,由此得出的结论是.
I.观察待测液的颜色,溶液呈无色;
Ⅱ,取少量待测液,滴加NaOH溶液,先无明显现象,后有白色沉淀生成;
Ⅲ.另取少量待测液,加入BaCl2溶液,无明显现象.
回答下列问题:
-
(1) 据此可以判断该待测液中一定大量存在的离子是,一定不能大量存在的离子是,不能确定是否存在的离子是.
-
(2) 依次写出Ⅱ中加入NaOH溶液过程中发生反应的离子方程式:,.

-
(1) 若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途:
-
(2) 若A、B、C、D都是化合物,其中A为H2O,B、C、D均含有氮元素,则B为色气体;
-
(3) 若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于制作印刷电路板,该反应的离子方程式为.
-
(4) 若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是
![]()
步骤I,取该溶液10.0mL,加入过量1.0mol/L Ba(NO3)2溶液,产生白色沉淀A和无色气体B,B遇空气立即变为红棕色;
步骤Ⅱ.向I所得的溶液中加入过量1.0mol/L NaOH溶液,有红褐色沉淀C和无色刺激性气体D生成.用铂丝蘸取所得溶液,在火焰上灼烧,火焰呈黄色;
步骤Ⅲ.向Ⅱ所得的溶液中通入过量CO2有沉淀E生成.
下列推断错误的是( )

试回答下列问题:
-
(1) 写出下列各物质的化学式:A、H.
-
(2) 按要求写出下列反应的有关方程式
①A→E反应的离子方程式;
②E→F 反应的化学方程式;
-
(3) 常温下可以用铝制容器盛装浓D,是因为,将铁粉逐渐加入100ml浓H中直至过量,按先后顺序写出所发生反应的离子方程式:.

据此回答下列问题:
-
(1) Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是.
-
(2) 写出下列B,C,E所含物质的化学式
固体B;沉淀C;溶液E.
-
(3) 写出①、②、③三个反应的离子方程式,不是离子反应的写出其化学方程式.
①;②;③.

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
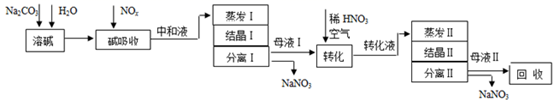
已知:Na2CO3+NO+NO2=2NaNO2+CO2
-
(1) 中和液所含溶质除NaNO2及少量Na2CO3外,还有(填化学式)。
-
(2) 中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是。蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的(填操作名称)最合理。
-
(3) 母液Ⅰ进行转化时加入稀HNO3的目的是。母液Ⅱ需回收利用,下列处理方法合理的是。
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液 d.转入结晶Ⅱ操作
-
(4) 若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38吨NaNO2时,Na2CO3的理论用量为吨(假定Na2CO3恰好完全反应)。
| 选项 | 实验操作 | 现象 | 结论 |
| A | 取一根洁净的铂丝,放在酒精灯火焰上灼烧至无色,然后蘸取少量试液,置于火焰上灼烧,透过蓝色钴玻璃观察 | 火焰呈紫色 | 溶液为钾盐 |
| B | 向Fe(NO3)2样品溶液中加入稀硫酸,然后再滴入KSCN溶液 | 溶液呈血红色 | Fe(NO3)2已变质 |
| C | 向溶液中加入盐酸酸化的氯化钡溶液 | 产生白色沉淀 | 溶液中含有 |
| D | 向某溶液中加入足量NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 试纸变蓝色 | 溶液中含有 |
 和
和  固体混合物
固体混合物 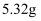 ,溶于水后加入
,溶于水后加入 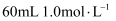 的
的 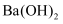 溶液充分反应,经过滤、洗涤、干燥,称得沉淀
溶液充分反应,经过滤、洗涤、干燥,称得沉淀 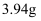 ,为将滤液处理至中性后达标排放,需加入
,为将滤液处理至中性后达标排放,需加入 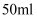 稀硫酸.请计算:
稀硫酸.请计算:
-
(1) 混合物中
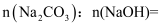 。
。
-
(2) 稀硫酸的物质的量浓度c=。
-
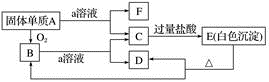
(1) 写出各物质的化学式:
A.、B、C、
D.、E、F。
-
(2) B与a溶液反应的离子方程式是。
-
(3) A与a溶液反应的离子方程式是。

-
(1) A的化学式为。
-
(2) D溶液暴露在空气中颜色逐渐变黄,写出该过程的离子方程式。
-
(3) 设计一个实验方案验证溶液D中的金属阳离子。
 溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图)。对反应后的溶液进行分析,溶液中
溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图)。对反应后的溶液进行分析,溶液中 与
与 之比为2∶3。下列说法不正确的是( )
之比为2∶3。下列说法不正确的是( )

 B . 反应的离子方程式为:
B . 反应的离子方程式为: C . 反应后的溶液中:
C . 反应后的溶液中: D . 反应后的溶液再生为
D . 反应后的溶液再生为 :加入足量铁粉,过滤,滤液中通入足量
:加入足量铁粉,过滤,滤液中通入足量

回答下列问题:
-
(1) “浸取”时为加快浸取速率,可以采取的措施有 (任写一条)。
-
(2) “除杂”包括加适量锌粉、过滤、加H2O2氧化等步骤。“加入H2O2氧化”的目的是,除Pb2+和Cu2+外,与锌粉反应的离子还有(填离子符号)。
-
(3) “沉锌铁”时反应体系温度不能过高,可能的原因是。
-
(4) 400 ℃时,将一定比例H2、CO、CO2和H2S的混合气体以一定流速通过装有脱硫剂ZnFe2O4的硫化反应器。
①硫化过程中,ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为。
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,但反应前后ZnS的质量不变, ZnS的作用是,生成COS的总反应化学方程式为。
-
(5) 将硫化后的固体在V(N2) : V(O2) =95 : 5的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400 ℃范围内,固体质量增加的主要原因可能是。


回答下列问题:
-
(1) 反应①的化学方程式为。
-
(2) F中所含非金属元素的化合价为价;上述物质中,属于非金属氧化物的是。
-
(3) 反应②的离子方程式为;该反应中,每生成3.36L(标准状况)气体G时,消耗F的质量为g。





