实验3-1 几种无机离子的检验 知识点题库

请回答下列问题:
-
(1) 写出F的电子式:;
-
(2) ①C溶液与D的水溶液反应的离子方程式为;
②F溶液与NaOH溶液共热反应的化学方程式为;
-
(3) ①请用离子方程式解释C溶液为何显酸性;
②F溶液中离子浓度由大到小的顺序为;
-
(4) 将5.4 g A投入到200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是 (填代号);A . HNO3溶液 B . H2SO4溶液 C . NaOH溶液 D . HCl溶液
-
(5) 将1mol N2和3mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得D的物质的量浓度为a mol/L.在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5mol G达到平衡后,D的物质的量浓度(填“大于”“小于”或“等于”)a/2mol/L.

请回答下列问题:
①E 和J的电子式分别是 和.
②写出F和CO2反应的化学方程式并用单线桥法表示电子转移的情况
③将少量单质C通入盛有淀粉碘化钾溶液的试管中,溶液变蓝色,该反应的离子方程式为.
④标况下3.36L气体B与A完全反应,转移电子的数目为.
-
(1) 若Y是黄绿色气体,则Y的电子式是,该反应的离子方程式是.
-
(2) 若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是.
-
(3) 若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是(填所在周期和族);Y的化学式是.
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是
mol.
-
(4) 若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是.

-
(1) B的化学式为。
-
(2) K的电子式为。
-
(3) 写出反应①的化学方程式:。
-
(4) 写出反应②的离子方程式:。

-
(1) ①若装置A中的试管不加热,则没有明显现象,原因是。
②证明有SO2 生成的现象是;为了证明气体中含有氢气,装置B和C中加入的试剂分别为X、CuSO4 , 请写出装置B处反应的化学方程式。
-
(2) 取装置A试管中的溶液6mL,加入适量氯水恰好反应,再加入过量的KI溶液后,分别取2mL此溶液于3支小试管中进行如下实验:
①第一支试管中加入1mLCCl4 , 充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号),由此可以证明该离子与I-发生的氧化还原反应为。
-
(3) 向盛有H2O2溶液的试管中加入几滴装置A试管中的溶液,溶液变成棕黄色,发生反应的离子方程式为;一段时间后,溶液中有气泡出现并放热,随后有红褐色沉淀生成。产生气泡的原因是;生成沉淀的原因是 (用平衡移动原理解释)。
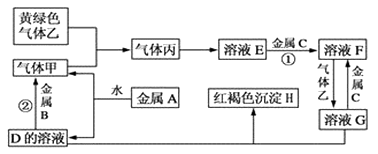
请根据以上信息回答下列问题:
-
(1) 写出下列物质的化学式:A;H ; G;乙。
-
(2) 检验溶液G中金属阳离子常用的试剂是:,现象:。
-
(3) 写出下列反应的离子方程式:
反应①;
反应②。

-
(1) A所含元素在周期表中的位置为,C的电子式为。
-
(2) A与H在加热条件下反应的化学方程式为。
-
(3) 将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为,I是较强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量之比为1∶4,该反应的离子方程式为。
-
(4) 向含有0.4 mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),过滤,向反应后澄清溶液中加入过量FeCl3溶液,得到沉淀3.2 g,则a=L。
 Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。 
-
(1) Ⅰ.溶液探究
将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+ , 可另取稀释液少许,滴加(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
-
(2) 为判断反应停止后硫酸是否有剩余,制定的实验方案为:测定稀释液的pH。请对此实验设计进行评价。。
-
(3) Ⅱ.气体探究
将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由。
最后逸出的气体具有可燃性,推测该气体为H2 , 理由是(用离子方程式表示)。
-
(4) 收集混合气体336mL(已折算成标准状况),通入足量的氯水中,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl。滴加足量BaCl2溶液,生成的沉淀经过滤、洗涤、干燥、称量,测得质量为2.330g。则混合气体中SO2的体积分数为。(精确至小数点后第二位)
-
(5) 将上述混合气体直接通入BaCl2溶液,未见明显现象,放置一段时间后发现有少许浑浊,分析其中的原因。
-
(1) Ⅰ.用甲酸和浓硫酸制取一氧化碳
A.
 B.
B.  C.
C.  D.
D. 
请说出图B中盛装碱石灰的仪器名称。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是;实验时,不需加热也能产生CO,其原因是。
-
(2) 如需收集CO气体,连接上图中的装置,其连接顺序为:a→(按气流方向,用小写字母表示)。
-
(3) Ⅱ.对一氧化碳的化学性质进行探究
资料:ⅰ.常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
ⅱ.一定条件下,CO能与NaOH固体发生反应:CO+NaOH
 HCOONa
HCOONa利用下列装置进行实验,验证CO具有上述两个性质。

打开k2 , F装置中发生反应的化学方程式为;为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是,H装置的作用是。
-
(4) 现需验证E装置中CO与NaOH固体发生了反应,某同学设计下列验证方案:取少许固体产物,配置成溶液,在常温下测该溶液的pH,若pH>7,证明CO与NaOH固体发生了反应。该方案是否可行,请简述你的观点和理由:,。
-
(5) 25℃甲酸钠(HCOONa)的水解平衡常数Kh的数量级为。若向100ml 0.1mol.L-1的HCOONa溶液中加入100mL0.2mol.L-1的HCl溶液,则混合后溶液中所有离子浓度由大到小排序为。
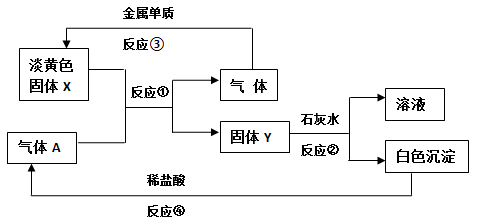
请回答下列问题
-
(1) 固体X的名称 ,A的化学式 。
-
(2) 反应①的化学方程式。
-
(3) 写出反应②④的离子方程式:。。

 :产生红褐色沉淀
B .
:产生红褐色沉淀
B .  :溶液变红色
C .
:溶液变红色
C .  :产生大量气泡
D .
:产生大量气泡
D .  :试管中先出现白色沉淀,后溶解
:试管中先出现白色沉淀,后溶解

a.氢氧化铁胶体 b.氢氧化钠 c. 溶液 d.明矾 e.氧化铝 f.稀硫酸酸化的硫酸亚铁溶液 g.84消毒液 h.稀盐酸 i.二氧化硅 j.偏铝酸钠
溶液 d.明矾 e.氧化铝 f.稀硫酸酸化的硫酸亚铁溶液 g.84消毒液 h.稀盐酸 i.二氧化硅 j.偏铝酸钠
请完成下列各题:
-
(1) 属于氧化物的有(填序号,下同),能净水的有,属于盐的有。
-
(2) d的化学式是,g的有效成分是(填化学式)。
-
(3) 向f中滴加几滴c,观察到的现象是,发生反应的离子方程式为。
-
(4) 向d溶液中加入过量b溶液,发生反应的离子方程式为。
-
(5) 向含8.2克j的水溶液中滴入100 mL 2.0 mol/L的h,反应后分散系中铝元素的存在形式为(填化学符号)。
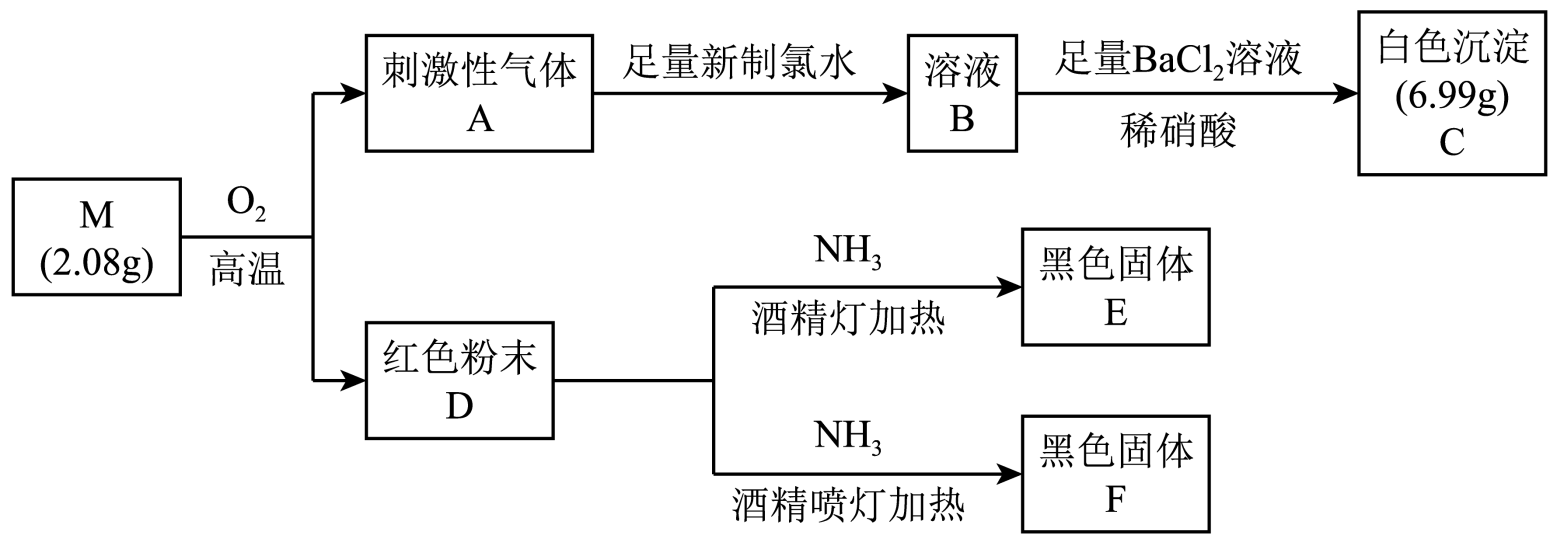
回答下列问题:
-
(1) D是(填化学式)。
-
(2) 根据上述信息推知,M是(填化学式)。
-
(3) 将A通入新制氯水中发生主要反应的离子方程式为。
-
(4) 为了探究温度对D和氨气反应的产物的影响,设计如下实验:
步骤
操作
E(甲组)
F(乙组)
I
取少量产物,加入稀盐酸
溶解、无气泡
溶解,有气泡
II
取步骤I中溶液,滴加KSCN溶液
溶液变红
无明显变化
III
向步骤II溶液中滴加双氧水
红色变深
溶液变红
①根据上述现象,得出实验结论:E为X3O4(X表示形成化合物M的一种元素),F为(填化学式)。
②乙组实验中,步骤III中溶液由无色变红的原因是(用离子方程式表示)。
③通过交流、讨论,有人认为E中除X3O4外还可能含单质X,判断的理由是。

-
(1) A与E反应生成F的化学方程式为。
-
(2) B的化学式为。
-
(3) 单质F与过量稀硝酸反应的化学方程式为。
-
(4) 实验室收集气体H时,验满的方法是。
-
(5) 组成X的四种元素为,黄色晶体的化学式为。
 、
、 、
、 、
、 等)中回收的
等)中回收的 可用作半导体镀层的蒸镀材料。回收过程可表示为
可用作半导体镀层的蒸镀材料。回收过程可表示为
资料:①“熔炼”过程中,单质硅和大部分单质铁转化为熔融物分离出来: 和
和 不易被C还原,且
不易被C还原,且 难溶于盐酸;草酸可与多种金属离子形成可溶性配合物。
难溶于盐酸;草酸可与多种金属离子形成可溶性配合物。
②常温下, 、
、 、
、 的
的 分别为
分别为 、
、 、
、 。
。
-
(1) “酸浸”时,滤渣的主要成分除了C之外,还有(填化学式)。
-
(2) “氧化”时,反应的离子方程式为。
-
(3) 常温下“调pH”时,溶液中
 , 为了除去杂质离子,应控制的pH范围是。
, 为了除去杂质离子,应控制的pH范围是。
-
(4) “沉钪”时,发生反应
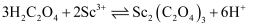 。反应过程中,测得钪的沉淀率随反应物起始物质的量比
。反应过程中,测得钪的沉淀率随反应物起始物质的量比 的变化如图-1所示。当
的变化如图-1所示。当 时,钪的沉淀率开始下降的原因是。
时,钪的沉淀率开始下降的原因是。
-
(5) 草酸钪晶体[
 ]在加热后,固体质量随温度变化曲线如图-2所示。在550~850℃范围内,反应的化学方程式为。
]在加热后,固体质量随温度变化曲线如图-2所示。在550~850℃范围内,反应的化学方程式为。



