实验3-1 几种无机离子的检验 知识点题库
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,下表格是它的说明书.

-
(1) 该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用.
1为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为 硫氰化钾溶液 ( 填试剂的名称 )
②实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应).请配平下列离子方程式
MnO4﹣+ Fe2++ H+═ Mn2++ Fe3++ H2O
③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液,取出20.00mL,用0.01mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL.该药品可以服用吗? (填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程) .
-
(2) 已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸.含23.6g琥珀酸的溶液与4mol/L 100mL的氢氧化钠溶液恰好完全中和.质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子.写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方 程式(有机物须写结构简式) ,琥珀酸亚铁的化学式为 .
![]()
-
(1) 若A是一种可用于自来水消毒的黄绿色气体,D是生活中常用的金属单质,则C的化学式为;写出A与C反应的离子方程式.
-
(2) 若A是一种常见的强碱,C常用于糕点发酵,则反应①的离子方程式是.
-
(3) 若A是一种碱性气体,常用作制冷剂,B,D是空气中的主要成分,则C的化学式为.
-
(4) 若A是一种无色、有臭鸡蛋气味的气体,C是导致酸雨的主要气体,则反应③的方程式为.
由此,可判定各试剂瓶中所盛试剂为:(填写溶质的化学式)
-
(1) A、E.
-
(2) 请写出下列反应的离子方程式:
A与E:.
B与E:.
C与E:.
①将少许混合物放入水中得到无色溶液和白色沉淀,过滤;
②取溶液进行焰色反应,火焰呈黄色;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体.
由上述现象推断:
-
(1) 该混合物中一定含有;一定不含有,可能含有;
-
(2) 若要检验可能含有的物质是否存在,可以采用的实验操作为 (填写字母).A . 取步骤①中滤液,加入AgNO3溶液,再加稀硝酸 B . 取步骤①中滤液,加入NaOH溶液 C . 取步骤①中滤液,加入足量Ba(NO3)2溶液,静置后在上层清液中加入酸化AgNO3溶液 D . 取步骤①中滤液,加入足量BaCl2溶液,静置后在上层清液中加入酸化AgNO3溶液.
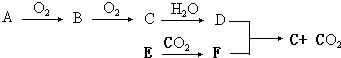
-
(1) A可以是或;
-
(2) E在CO2中燃烧的化学方程式为;
-
(3) D与F反应的化学方程式为,该反应中D表现了性;
-
(4) 50mL 14mol•L﹣1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为mol,参加反应的铜的质量为g.
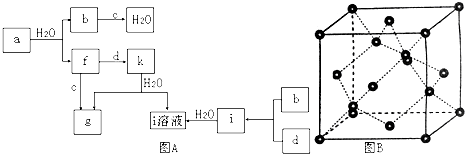
回答下列问题:
-
(1) 图B对应的物质名称是,
-
(2) d中元素的原子核外电子排布式为.
-
(3) 图A中由二种元素组成的物质中,沸点最高的是,原因是,该物质的分子构型为.
-
(4) 图A中的双原子分子中,极性最大的分子是.
-
(5) k的分子式为,中心原子的杂化轨道类型为,属于分子(填“极性”或“非极性”).
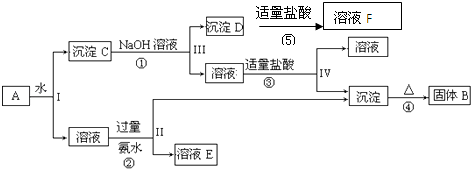
回答下列问题:
-
(1) 写出所含物质的化学式:固体B,沉淀D。
-
(2) 写出①、④两个反应的化学方程式:
①
④
-
(3) 写出②、③两个反应的离子方程式:
②
③
-
(4) 设计实验检验溶液F中所含溶质的阳离子:。
-
(5) 分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3︰
Fe2O3︰

选项 | 甲 | 乙 | 丙 | 戊 |
A | NH3 | Cl2 | N2 | H2 |
B | H2S | SO2 | S | O2 |
C | AlCl3 | NaOH | Na[Al(OH)4] | HCl |
D | Br2 | FeI2 | FeBr2 | Cl2 |
|
选项 |
实验操作 |
实验现象 |
实验结论 |
|
A |
将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液 |
溶液变成红色 |
Fe(NO3)2样品中一定含有Fe3+ |
|
B |
向KI溶液中加入少量苯,然后加入FcCl3溶液 |
有机层呈橙红色 |
还原性Fe3+>I- |
|
C |
向浓度均为0.1mol/L的Na2CO3和Na2S混合溶液滴入少量AgNO3溶液 |
产生黑色沉淀(Ag2S) |
Ksp(Ag2S)>Ksp(Ag2CO3) |
|
D |
向某溶液中加入KOH溶液并加热,管口放湿润的红色石蕊试纸 |
试纸变为蓝色 |
原溶液片含有NH4+ |
|
物质 |
V2O5 |
V2O4 |
K2SO4 |
SiO2 |
Fe2O3 |
Al2O3 |
|
质量分数/% |
2.2~2.9 |
2.8~3.1 |
22~28 |
60~65 |
1~2 |
<1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
-
(1) “酸浸”时V2O5转化为VO2+ , 反应的离子方程式为,同时V2O4转成VO2+。“废渣1”的主要成分是。
-
(2) “氧化”中欲使3 mol的VO2+变为VO2+ , 则需要氧化剂KClO3至少为mol。
-
(3) “中和”作用之一是使钒以V4O124−形式存在于溶液中。“废渣2”中含有。
-
(4) “离子交换”和“洗脱”可简单表示为:4ROH+ V4O124−
 R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈性(填“酸”“碱”“中”)。
R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈性(填“酸”“碱”“中”)。
-
(5) “流出液”中阳离子最多的是。
-
(6) “沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式。

已知:Ksp[Mg(OH)2]=10-11 , Ksp[Al(OH)3]=10-33 , Ksp[Fe(OH)3]=10-38
回答下列问题:
-
(1) 为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈,可以认为该矿石中存在锂元素。
a.紫红色 b.紫色 c.黄色
-
(2) 锂辉石的主要成分为LiAlSi2O6 , 其氧化物的形式为。
-
(3) 为提高“酸化焙烧”效率,常采取的措施是。
-
(4) 向“浸出液”中加入CaCO3 , 其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、Al3+完全沉淀,则pH至少为。(已知:完全沉淀后离子浓度低于1×10-5)mol/L)
-
(5) “滤渣Ⅱ”的主要化学成分为。
-
(6) “沉锂”过程中加入的沉淀剂为饱和的溶液(填化学式);该过程所获得的“母液”中仍含有大量的Li+ , 可将其加入到“”步骤中。
-
(7) Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为。
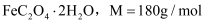 )常用于晒制蓝图。某研究性学习小组对其进行了系列探究。
)常用于晒制蓝图。某研究性学习小组对其进行了系列探究。
-
(1) I.纯净的草酸亚铁晶体热分解产物的探究
气体产物成分的探究,小组成员采用如下装置(可重复选用)进行实验:
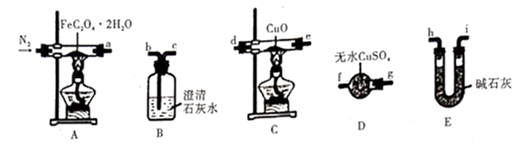
①E中盛装碱石灰的仪器名称为。
②按照气流从左到右的方向,上述装置的接口顺序为
 尾气处理装置。
尾气处理装置。③实验前先通入一段时间
 ,其目的是。
,其目的是。④实验证明气体产物中含有
 ,依据的实验现象为。
,依据的实验现象为。 -
(2)
 受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,
受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,  晶体受热分解的化学方程式。
晶体受热分解的化学方程式。 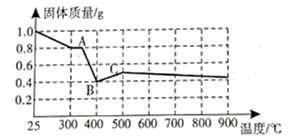
-
(3) 晒制蓝图时,以
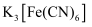 溶液为显色剂,写出
溶液为显色剂,写出 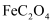 与
与 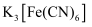 溶液反应的化学方程式。
溶液反应的化学方程式。
-
(4) Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有
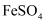 杂质测定其纯度的步骤如下:
杂质测定其纯度的步骤如下:步骤1:称取
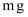 草酸亚铁晶体样品溶于稀
草酸亚铁晶体样品溶于稀  中,配成
中,配成  溶液;
溶液;步骤2:取上述溶液
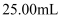 ,用
,用 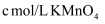 ,标准液滴定至终点消耗标准液
,标准液滴定至终点消耗标准液  ;
;步骤3:向反应后溶液中加入适量锌粉充分反应后加入适量稀
 ,再用
,再用 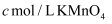 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 
①步骤2中滴定终点的现象为,步骤3中加入锌粉的目的是。
②草酸亚铁晶体样品的纯度为(写出计算表达式)。
请回答下列问题:
-
(1) 写出A、B、C、D、E、F的化学式
A;B;C;D;E;F。
-
(2) 写出F和H反应的化学方程式。
-
(3) 写出下列反应的离子方程式:
①D+盐酸;
②B+水;
③D+A。

-
(1) 形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为,Ni(CO)4含有的化学键类型。
-
(2) Ni2O3有强氧化性,加压酸浸时,有气体产生且镍被还原为Ni2+ , 则产生的气体为(填化学式)。
-
(3) 滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体生成单质镍的离子方程式:。
-
(4) “高温熔融”时通入氩气的目的是。
-
(5) 检验滤液C中金属阳离子的试剂是(填标号)。
a.KSCN溶液 b.K3[Fe(CN)6] c.酸性高锰酸钾 d.苯酚
-
(6) 碱浸的目的是使镍铝合金产生多孔结构,其原理(用化学方程式表示)。
 B . 可用KSCN溶液鉴别
B . 可用KSCN溶液鉴别  溶液和
溶液和 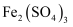 溶液
C . 合金的熔点一定比各成分金属的低
D . 稀土金属可以用于生产合金
溶液
C . 合金的熔点一定比各成分金属的低
D . 稀土金属可以用于生产合金

已知:AgCl可溶于氨水:
下列说法不正确的是( )
 条件下进行,可用水浴加热
B . 为加快“溶解”速率,可采用高温条件
C . 实验室中过滤时使用的玻璃仪器有烧杯、漏斗、玻璃棒
D . 为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤后的滤液合并入过滤Ⅱ的滤液中
条件下进行,可用水浴加热
B . 为加快“溶解”速率,可采用高温条件
C . 实验室中过滤时使用的玻璃仪器有烧杯、漏斗、玻璃棒
D . 为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤后的滤液合并入过滤Ⅱ的滤液中

-
(1) 步骤Ⅰ、步骤Ⅲ发生反应的离子反应方程式为、。
-
(2) 步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是。
-
(3) 步骤Ⅱ通入热空气或水蒸气吹出Br2 , 利用了溴的。(填性质)
-
(4) 步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:。
 Br2+
Br2+ CO
CO =
= BrO
BrO +
+ Br-+
Br-+ CO2↑
CO2↑ -
(5) 步骤Ⅱ中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。若从1000L海水中提取溴,理论上需要SO2的质量为。
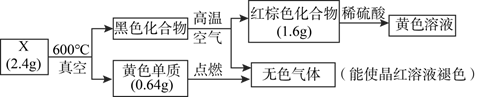
-
(1) 组成物质X的元素是。
-
(2) 黑色化合物转化为红棕色化合物的方程式为。
-
(3) 写出红棕色化合物与稀硫酸反应的离子方程式:
-
(4) 设计实验方案检验黄色溶液中的金属阳离子



