实验3-4 酸碱滴定曲线的测绘 知识点题库
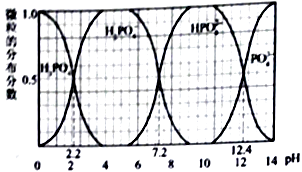
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是 (填编号).
(2)将上述物质的量浓度均为0.1mol/L的五种溶液稀释相同倍数时,其pH变化最大的是 (填编号).
(3)在上述五种电解质溶液中分别加入AlCl3溶液,无气体产生的是 (填编号)
(4)将上述①、②、③、④这四种电解质溶液混合,发生反应的离子方程式为 .
| 选项 | 实验操作和现象 | 结论 |
| A | 某溶液 | 原溶液中一定含有CO32- |
| B | 用湿润的pH试纸测某碱液的pH,测定值偏小 | 湿润的pH试纸测量任何溶液都会产误差 |
| C | 将浓硫酸倒入蔗糖中搅拌蔗糖迅速变黑并伴有刺激性气味 | 浓硫酸具有脱水性和强氧化性 |
| D | 将乙烯和苯分别加入到溴水中,都能使溴水层褪色 | 乙烯和苯分子中都含有碳碳双键 |
 均等于K
均等于K
-
(1) 已知常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3⇌HCO
 + H+的平衡常数K1=。(已知10-5.60=2.5×10-6)
+ H+的平衡常数K1=。(已知10-5.60=2.5×10-6)
-
(2) 已知H2CO3的第二级电离常数Ka2=5.6×10-11 , HClO的电离常数K=3.0×10-8 , 写出下列所发生反应的离子方程式:
a.少量Cl2通入过量的Na2CO3溶液中:。
b.少量CO2通入过量的NaClO溶液中:。
-
(3) 人体血液里主要通过碳酸氢盐缓冲体系(
 )维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1 ,
)维持pH稳定。已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1 ,  ≈
≈ 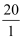 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为,当过量的酸进入血液中时,血液缓冲体系中
,1g2=0.3。由题给数据可算得正常人体血液的pH约为,当过量的酸进入血液中时,血液缓冲体系中  的值将(填“变大、变小、不变”)。
的值将(填“变大、变小、不变”)。
-
(4) NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO
 、CO
、CO  三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3 , 宜控制溶液的pH为之间
三种成分平衡时的组成分数如图所示,若用CO2和NaOH反应制取NaHCO3 , 宜控制溶液的pH为之间 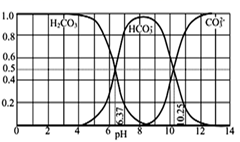
| 选项 | 实验操作 | 现象 | 结论 |
| A | Cu与足量浓硫酸反应,将反应混合物冷却后,再向反应器中加入冷水 | 溶液变蓝 | 验证生成Cu2+ |
| B | 用惰性电极电解FeCl2和盐酸的混合溶液,电解一段时间后,在阳极附近滴加KSCN溶液 | 阳极附近溶液变红并无气泡产生 | Fe2+的还原性强于Cl- |
| C | 向CuSO4溶液中通入H2S | 出现黑色沉淀 | 酸性:H2S>H2SO4 |
| D | 用洁净的玻璃棒蘸取NaClO溶液点在pH试纸中部 | pH试纸变蓝 | NaClO溶液呈碱性 |
| 目的 | 操作 | |
| A | 测定NaClO溶液的pH | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取待测液点滴于试纸的中部,与标准比色卡对比 |
| B | 验证Ksp(AgCl)>Ksp( AgI) | 取2 mL0. 1mol·L-1AgNO3溶液,先后滴加3滴0.1mol·L-1NaCl溶液和5滴0.1mol·L-1KI溶液,先生成白色沉淀,后又产生黄色沉淀 |
| C | 证明Na2CO3溶液中存在水解平衡 | 向含有酚酞的Na2CO3溶液中滴人BaCl2溶液,观察溶液的变化 |
| D | 检验Fe(NO3)2晶体是否已 氧化变质 | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 |
①用pH试纸测定Na2CO3溶液的pH;
②取某溶液做焰色试验,检验该溶液中是否含有钠元素;
③用饱和FeCl3溶液和沸水制取Fe(OH)3胶体;
④配制一定物质的量浓度氯化钠溶液
选项 | 操作 | 目的 |
A | 除去 | 向混合物中加入足量NaOH溶液,充分反应后过滤、洗涤、干燥 |
B | 测定相同浓度的HCl溶液、HBr溶液的pH | 比较Cl和Br的非金属性强弱 |
C | 将相同大小的镁片和铝片用导线连接,插入NaOH溶液中 | 证明原电池中活泼性较强的金属作负极 |
D | 向蔗糖溶液中加入新制的银氨溶液,水浴加热 | 证明蔗糖是非还原性糖 |
 生成使石灰水变浑浊的无色气体
生成使石灰水变浑浊的无色气体 中的
中的 杂质
杂质


