第三章 探索原子构建物质的奥秘 知识点题库
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的是( )
A . ZXY3
B . ZX2Y6
C . ZX4Y8
D . ZX8Y12
下列表示电子式的形成过程正确的是( )
A .  B .
B .  C .
C .  D .
D . 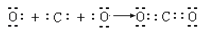
 B .
B .  C .
C .  D .
D . 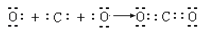
下列说法正确的是( )
A . 仅由非金属元素不可能形成离子化合物
B . 构成分子的粒子一定含有共价键
C . 离子化合物中可能含有共价键
D . 凡是有化学键断裂过程一定发生了化学反应
下列各项所述的数字不是6的是( )
A . 在NaCl晶体中,与一个Na+最近的且距离相等的Cl﹣的个数
B . 在金刚石晶体中,围成最小环的原子数
C . 在二氧化硅晶体中,围成最小环的硅原子数
D . 在CsCl晶体中,与一个Cs+最近的且距离相等的Cl﹣的个数
下列说法中正确的是( )
A . C60气化和干冰升华克服的作用力相同
B . 分子晶体在水溶液中一定能导电
C . 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D . 用作高温结构陶瓷材料的Si3N4固体是分子晶体
以下过程与化学键断裂无关的是()
A . 金刚石熔化
B . 氯化氢溶于水
C . 氢氧化钾熔化
D . 冰融化
关于晶体的叙述中,正确的是( )
A . 原子晶体中,共价键的键能越大,熔、沸点越高
B . 分子晶体中,分子间的作用力越大,该分子越稳定
C . 分子晶体中,共价键的键能越大,熔、沸点越高
D . 某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
请将正确的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
-
(1) 化学键没有被破坏的是;仅发生离子键破坏的是;
-
(2) 即发生离子键破坏、又发生共价键破坏的是;
-
(3) N2的电子式为;Na2O2的电子式为;CO2的电子式为。
微粒间的作用力主要有离子键、共价键、金属键(存在于金属单质与合金中)、一般的 分子间作用力和氢键,下列各组物质中,所含有的相互作用力类型最多的一组是( )
A . Na2O2 Na2O
B . KClO CO2
C . K HBr
D . HF NaOH
下列关于微粒间作用力与晶体的说法不正确的是( )
A . 某物质呈固体时不导电,熔融状态下能导电,则该物质一定是离子晶体
B . H2O和CCl4的晶体类型相同,且每个原子的最外层都达到8电子稳定结构
C . F2、Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力逐渐增大
D . 干冰溶于水中,既有分子间作用力的破坏,也有共价键的破坏
H2O2俗称双氧水,医疗上常用3%的双氧水进行伤口或耳炎消毒。下列关于H2O2的说法正确的是( )
A . H2O2分子中含有氢离子
B . H2O2分子中既有离子键,又有共价键
C . H2O2属于共价化合物
D . H2O2属于H2和O2组成的混合
有关晶体的结构如图所示,下列说法中错误的是( )

A . 在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
B . 该气态团簇分子(图乙)的分子式为EF或FE
C . 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D . 在碘晶体(图丁)中,存在的作用力有非极性共价键和范德华力
下列各组物质中,含有共价键但属于离子化合物的是( )
A . NH4NO3
B . MgCl2
C . HF
D . H2O
熔融时需要破坏共价键的化合物是( )
A . 冰
B . 石英
C . 金刚石
D . 氢氧化钠
以下描述正确的是( )
①离子化合物中只存在离子键,共价化合物中只存在共价键②活泼非金属元素与活泼金属元素只能形成离子键③非金属元素间只能形成共价化合物④所有物质中均存在化学键⑤HF比HCl、HBr、HI更稳定,是因为HF分子间存在氢键
A . ①⑤
B . ②④⑤
C . ④⑤
D . 以上均不符合题意
锌与硫所形成化合物晶体的晶胞如图所示。下列判断正确的是( )

A . 该晶体属于分子晶体
B . 该晶胞中Zn2+和S2-数目相等
C . 阳离子的配位数为6
D . 氧化锌的熔点高于硫化锌
下列叙述正确的是( )
A . PCl3 和 BCl3 分子中所有原子的最外层都达到 8 电子稳定结构
B . H2S 和 CS2分子都是含极性键的极性分子
C . (CN)2为直线形分子,含有 3 个σ键和 4 个π键
D . NF3 与 NH3 的空间构型都是三角锥形,都易与 Cu2+形成配离子
由一种阳离子与两种酸根离子组成的盐称为混盐。向混盐CaOCl2中加入足量浓硫酸,可发生反应:CaOCl2 +H2SO4(浓)=CaSO4 +Cl2↑+H2O。下列说法错误的是(NA表示阿伏加德罗常数的值)( )
A . 混盐CaOCl2 中既含离子键又含共价键
B . 浓硫酸体现氧化性与酸性
C . 每产生1mol氯气,转移电子数为NA
D . 1mol混盐CaOCl2中含有离子数为3NA
下列有关化学用语表述正确的是( )
A . 基态氮原子核外电子排布的轨道表示式: B . 用原子轨道描述氢分子中化学键的形成:
B . 用原子轨道描述氢分子中化学键的形成: C . 基态钙原子的简化电子排布式:[Ar]3d2
D . 一水合氨的电离方程式:
C . 基态钙原子的简化电子排布式:[Ar]3d2
D . 一水合氨的电离方程式:
 B . 用原子轨道描述氢分子中化学键的形成:
B . 用原子轨道描述氢分子中化学键的形成: C . 基态钙原子的简化电子排布式:[Ar]3d2
D . 一水合氨的电离方程式:
C . 基态钙原子的简化电子排布式:[Ar]3d2
D . 一水合氨的电离方程式:
下列物质属于离子晶体的是( )
A . 长方体形玻璃
B . NaNO3固体
C . 水晶
D . 钻石
最近更新



