第三章 探索原子构建物质的奥秘 知识点题库
(2)下列变化①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解.未发生化学键破坏的是 ;仅发生离子键破坏的是 ;仅发生共价键破坏的是
已知:①N60分子中每个氮原子均以N﹣N键结合三个N原子而形成8电子稳定结构;
②N﹣N键的键能为167kJ•mol﹣1.请回答下列问题.
(1)N60分子组成的晶体为 晶体,其熔、沸点比N2 (填“高”或“低”),原因是
(2)1mol N60分解成N2时吸收或放出的热量是 kJ(已知N≡N键的键能为942kJ•mol﹣1),表明稳定性N60 (填“>”、“<”或“=”)N2 .
(3)由(2)列举N60的用途(举一种)
①化学键存在分子之间
②任何物质中都存在化学键
③由非金属元素形成的化合物一定不是离子化合物
④离子键就是阴、阳离子之间的静电吸引力
⑤活泼金属与活泼非金属化合时能形成离子键
⑥任何共价键中,成键原子键后均满足稳定结构
⑦判断化合物是否为离子化合物的实验方法是看其熔化下能否导电
⑧熔融NaCl能导电,是因为通电时破坏了离子键,产生了自由移动的Na+和Cl﹣
⑨化学键断裂,一定发生化学变化.

-
(1) N元素在周期表中的位置为;Y的简单氢化物的稳定性(填“>”“<”或“=”)W的简单氢化物的稳定性。
-
(2) X、Z形成的含18电子的化合物的结构式为。
-
(3) 由X、Z、W、N四种元素组成的一种离子化合物A,已知A既能与盐酸反应,又能与氯水反应,写出A与足量盐酸反应的离子方程式。
-
(4) X和W组成的化合物中,既含有极性共价键又含有非极性共价键的是(填化学式),此化合物可将碱性工业废水中的CN-氧化,生成碳酸盐和氨气,相应的离子方程式为。
-
(1) X原子的电子排布式为,Y原子的价层电子轨道表示式为。
-
(2) YX2的分子构型是,YX2的熔、沸点比ZX2(选填“高”或“低”),理由是。
-
(3) 一个YX2分子中含个π键。
-
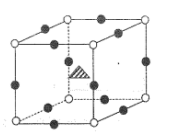
(4) 如图表示一些晶体的结构(晶胞),其中代表YX2的是。
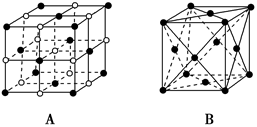

| A | B | C | D | |
| 离子化合物 | HNO3 | NH4Cl | NaOH | Na2O2 |
| 共价化合物 | CO2 | MgCl2 | H2O | NH3 |
| 所含化学键类型 | 前者有离子键 后者有共价键 | 两者均含有离子键 | 两者均含有共价键 | 前者只有离子键 后者只有共价键 |
-
(1) 基态Ti原子的价电子排布式为,核外不同空间运动状态的电子数为种。
-
(2) 已知电离能:I2(Ti)=1310kJ·mol-1 , I2(K)=3051kJ·mol-1.I2(Ti)<I2(K),其原因为。
-
(3) 钛某配合物可用于催化环烯烃聚合,其结构如下图所示:
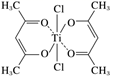
①钛的配位数为,碳原子的杂化类型有种。
②该配合物中存在的化学键有(填字母)。
a.离子键b.配位键c.金属键d.共价键e.氢键
-
(4) 钛与卤素形成的化合物熔、沸点如下表所示:
TiCl4
TiBr4
TiI4
熔点/℃
-24.1
38.3
155
沸点/℃
136.5
233.5
377
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是。
-
(5) 已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为,阴离子的立体构型为。

-
(6) 已知TiN晶体的晶胞结构如下图所示,若该晶胞的密度为ρg·cm-3 , 阿伏加德罗常数值为NA , 则晶胞中Ti原子与N原子的最近距离为pm。(用含ρ、NA的代数式表示)

-
(1) 基态Mn原子的价电子层电子排布式为。
-
(2) Ni2+可与丁二酮肟反应生成如下物质:
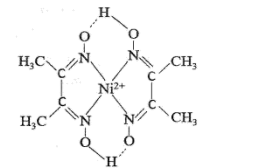
①该物质中含有的化学键类型有(填标号)。
A.共价键 B.离子键 C.配位键 D.金属键
②C、N、O的第一电离能由大到小的顺序是。
-
(3) [Ni(N2H4)2](N3)2是一种富氮含能材料,N2H4中氮原子的杂化方式为;写出一种与N
 互为等电子体的分子(填化学式);实验数据表明键角NH3>PH3>AsH3 , 分析原因是。
互为等电子体的分子(填化学式);实验数据表明键角NH3>PH3>AsH3 , 分析原因是。
-
(4) 氮与碳还能形成一种离子液体的正离子
 , 为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5 , 不能被H原子替换,原因是。
, 为使该正离子以单个形式存在以获得良好的溶解性能,与N原子相连的-C2H5 , 不能被H原子替换,原因是。
-
(5) 研究人员设计了新款Li3SBF4快离子导体,具有良好导电能力,为锂离子电池的发展做出了有益的贡献。晶胞图如下,其中BF
 位于体心,则
位于体心,则 位于(填“顶点”或“棱心”)。若该晶胞最近的
位于(填“顶点”或“棱心”)。若该晶胞最近的 与
与 距离为apm,则晶胞密度为g·cm-3(列出计算式)。
距离为apm,则晶胞密度为g·cm-3(列出计算式)。