第三章 探索原子构建物质的奥秘 知识点题库
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液.下列对此现象说法正确的是( )
A . 反应后溶液中不存在任何沉淀,所以反应前后[Cu(H2O)4]2+的数目不变
B . 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C . 向反应后的深蓝色溶液中加入乙醇,不会产生任何现象
D . 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
在下列有关晶体的叙述中错误的是( )
A . 离子晶体中,一定不存在共价键
B . 原子晶体中,只存在共价键
C . 金属晶体的熔沸点均很高
D . 稀有气体的原子能形成分子晶体
下列每组物质中含有的化学键类型相同的是( )
A . NaCl、HCl、H2O,NaOH
B . Cl2、Na2S,HCl、SO2
C . HBr、CO2、H2O,CS2
D . Na2O2、H2O2、H2O,O3
下列物质中只含共价键,且属于共价化合物的是( )
A . N2
B . NaOH
C . H2O
D . Ar
下列说法中正确的是( )
A . 两个原子或多个原子之间的相互作用叫做共价键
B . 阴、阳离子间通过静电引力而形成的化学键叫做离子键
C . 分子晶体中一定含有共价键,离子晶体中一定含有离子键
D . 氯化钠晶体中含有阳离子,氯化钠溶液中也含有阳离子
下列关于乙烯的说法中,正确的是( )
A . 在空气中燃烧,能产生黑烟
B . 分子中只含有极性共价键
C . 分子中C、H元素的质量为1:1
D . 通入氢气即可发生加成反应
下列关于化学键的叙述正确的是( )
A . 全部由非金属元素组成的化合物中可含离子键
B . H2O中所有原子都满足八电子稳定状态
C . 两种元素构成的化合物可以含有非极性共价键
D . CH4中所有的电子都参与形成共价键
了解有机物分子中化学键的特征以及成键方式是研究有机物性质的基础。下列关于有机物分子的成键方式的描述不正确的是( )
A . 烷烃分子中碳原子均采用sp3杂化
B . 炔烃分子中的碳碳三键由1个σ键、2个π键组成
C . 苯分子中所有碳原子均采用sp2杂化成键
D . 甲苯分子中所有碳原子均采用sp2杂化
下列化合物中,只存在离子键的是( )
A . NaOH
B . CO2
C . NaCl
D . HCl
电子式的运用
-
(1) 用电子式表示粒子:
①氢氧根离子;②羟基;③二氧化碳分子。
-
(2) 用电子式表示化合物的形成过程
④MgF2;⑤H2O 。
2020年9月7日,我国在太原卫星发射中心用长征四号乙运载火箭,成功将高分十一号02星送入预定轨道。N2H4、NH3等均可用作火箭推进剂。请回答下列问题:
-
(1) 某种运载火箭的推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢,一定量的N2H4(1)和H2O2(1)完全反应生成氮气和1mol气态水的过程中的能量变化如图所示。

①该反应属于(填“吸热”或“放热”)反应。
②写出N2H4中含有的共价键类型:。
③若该反应过程中N2H4中有8mol极性键发生断裂,则能量变化为kJ。
-
(2) 已知下列数据:
物质
NH3
H2O
N2
O2
断裂1mol化学键所需能量/kJ
391
463
942
496
则68g氨气完全燃烧生成氮气和气态水放出的热量为kJ。
下列有关化学用语的表示方法正确的是( )
A . 次氯酸的电子式: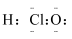 B .
B .  为乙烯的球棍模型
C . 用电子式表示MgCl2的形成过程为:
为乙烯的球棍模型
C . 用电子式表示MgCl2的形成过程为: D . 氮离子(
D . 氮离子( )的结构示意图:
)的结构示意图: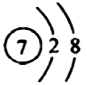
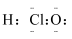 B .
B .  为乙烯的球棍模型
C . 用电子式表示MgCl2的形成过程为:
为乙烯的球棍模型
C . 用电子式表示MgCl2的形成过程为: D . 氮离子(
D . 氮离子( )的结构示意图:
)的结构示意图: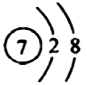
下列叙述中正确的是 ( )
A . 含离子键的化合物一定是离子化合物
B . 含共价键的化合物一定是共价化合物
C . 全部由非金属元素形成的化合物一定是共价化合物
D . 在离子化合物中也可能含有金属键
某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝,催化机理如图1,反应过程中不同态物质体系所含的能量如图2。下列说法错误的是( )

A . 总反应焓变ΔH<0
B . 由状态②到状③发生的是氧化还原反应
C . 状态③到状态④的变化过程中有O—H键的形成
D . 该脱硝过程的总反应方程式为4NH3+2NO+2O2=6H2O+3N2
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。回答下列问题:
-
(1) 钒(V)及其化合物广泛应用于工业催化、新材料等领域。
①基态钒原子的价电子排布式为。
②
 是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示:
是一种常见的催化剂,在合成硫酸中起到重要作用,其结构式如图所示: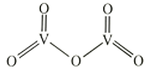
则
 分子中σ键和π键数目之比为。
分子中σ键和π键数目之比为。 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。
溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。 与
与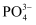 的空间构型相同,其中V原子的杂化方式为。
的空间构型相同,其中V原子的杂化方式为。 -
(2) ①科学研究表明用
 作光催化剂可处理废水中的
作光催化剂可处理废水中的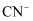 , 则
, 则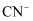 的电子式为。
的电子式为。②
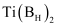 是一种储氢材料。基态B原子核外电子的运动状态有种。
是一种储氢材料。基态B原子核外电子的运动状态有种。 -
(3) 甘氨酸亚铁络合物[
 ]广泛用于缺铁性贫血的预防和治疗。
]广泛用于缺铁性贫血的预防和治疗。①
 中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。
中含有的第二周期元素的第一电离能由大到小的顺序为(用元素符号表示)。②甘氨酸 (
 )的沸点比相对分子质量相近的烷烃大很多,原因是。
)的沸点比相对分子质量相近的烷烃大很多,原因是。
回答下列问题
-
(1) 已知金刚石的莫氏硬度为10,石墨的莫氏硬度为
 , 从晶体结构的角度解释金刚石硬度很大,石墨很软的原因。
, 从晶体结构的角度解释金刚石硬度很大,石墨很软的原因。
-
(2) 在相同温度时,酸性条件下
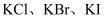 都能被
都能被 氧化,通过控制溶液中
氧化,通过控制溶液中 探究同浓度的
探究同浓度的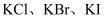 还原性强弱,预测同浓度的
还原性强弱,预测同浓度的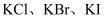 被
被 氧化需要的
氧化需要的 最小的是,试从离子结构角度解释
最小的是,试从离子结构角度解释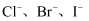 的还原性逐渐增强的原因。
的还原性逐渐增强的原因。
氢氟酸可用于雕刻玻璃,其反应原理为4HF+SiO2=SiF4↑+2H2O。下列有关说法正确的是( )
A . HF中的共价键为s-pσ键
B . H2O、SiF4均为极性分子
C . SiO2晶体为分子晶体
D . 基态氧原子的价层电子轨道表示式为
铀氮化合物是核燃料循环系统中的重要材料。
已知 。回答下列问题:
。回答下列问题:
-
(1) 基态氮原子价电子轨道表示式为。
-
(2) 反应中断裂的化学键有(填标号)。
a.氢键 b.极性键 c.非极性键 d.离子键 e.配位键
-
(3) 反应所得的气态产物中属于非极性分子的是(填化学式,下同);氢化物中更易与
 形成配离子的是,解释原因。
形成配离子的是,解释原因。
-
(4) 基态U原子的外围电子排布式为
 , 则处于下列状态的铀原子或离子失去一个电子所需能量最高的是____(填标号)。
A .
, 则处于下列状态的铀原子或离子失去一个电子所需能量最高的是____(填标号)。
A . B .
B .  C .
C .  D .
D . 
-
(5)
 的空间构型为,其结构中存在大π键,可表示为(用
的空间构型为,其结构中存在大π键,可表示为(用 表示,m代表参与形成大
表示,m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数)。
键的电子数)。
-
(6) 某种铀氮化物的晶胞如图。已知晶胞密度为
 , U原子半径为
, U原子半径为 , N原子半径为
, N原子半径为 , 设
, 设 为阿伏加德罗常数的值,则该晶胞的空间利用率为(用含d、
为阿伏加德罗常数的值,则该晶胞的空间利用率为(用含d、 、
、 、
、 的式子表示)。
的式子表示)。
下列关于晶体的说法错误的是( )
A . 熔融状态导电的晶体不一定是离子晶体
B . 金属晶体中一定含有金属键,金属键没有方向性和饱和性
C . 熔点是10.31℃,液态不导电,水溶液能导电的晶体一定是分子晶体
D . 具有正四面体结构的晶体,可能是共价晶体或分子晶体,其键角都是109°28′
HC3N是一种星际分子,分子内不含环状结构,下列有关这种星际分子的说法错误的是( )
A . HC3N的结构可能为H-C≡C-C≡N
B . HC3N为极性分子
C . HC3N中所含有的σ键与π键数目比为1:1
D . HC3N分子中所有原子不可能都在一条直线上
最近更新



