第三章 探索原子构建物质的奥秘 知识点题库
(1)写出下列物质的电子式:CO2 Na2O2
(2)用电子式表示下列物质的形成过程:NH3 、MgCl2
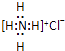 B . 用电子式表示氯化氢分子的形成过程:
B . 用电子式表示氯化氢分子的形成过程:  R
R
①离子化合物含离子键,也可能含极性键或非极性键 ②H2SO3的酸性>H2CO3的酸性,所以非金属性S>C ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤熔融状态能导电的化合物是离子化合物 ⑥由分子组成的物质中一定存在共价键

|
元素 |
A |
B |
C |
D |
|
性质结构信息 |
最常见氢化物X为三角锥分子且能与 HCl发生化合反应生成盐 |
原子的 M 层上电子数比L层电子数少2个 |
ds区元素,N 层上有一个电子 |
原子的s电子数是p电子数的2倍 |
-
(1) 写出基态B原子的电子排布式:。
-
(2) 向CSO4的溶液中逐滴加入过量X的水溶液,可生成的配合物的化学式为 ,该物质中不存在的作用类型为(填字母)。
a.离子键 b.配位键 c.极性键 d.氢键
-
(3) 下列几种氢化物分子:
① AH3 ②D2H2③H2B ④DH4
中心原子采用sp3杂化形成化学键的是 (填序号);在②的分子中有 个σ键,该分子中电子运动状态共有 种。
-
(1) 下列关于CaF2的表述正确的是。
a.F-的离子半径小于Cl- , 则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
-
(2) CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示)。 已知AlF63-在溶液中可稳定存在。
-
(3) F2通入稀NaOH溶液中可生成OF2 , OF2分子构型为,其中氧原子的杂化方式为。
-
(4) F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1 , F-F键键能为159kJ·mol-1 , Cl-Cl键键能为242kJ·mol-1 , 则ClF3中Cl-F键的平均键能为kJ·mol-1。ClF3的熔、沸点比BrF3的(填“高”或“低”)。

-
(1) 写出B元素的名称
-
(2) E在元素周期表中的位置为
-
(3) 写出A与B形成能使湿润的红色石蕊试纸变蓝的气体的电子式
-
(4) D的最高价氧化物对应水化物中存在的化学键是
-
(5) 写出D2C2与A2C反应的化学方程式

 NO2+H2O
B . 反应历程中还可能形成HONO···H2O
C . 该反应历程中最大能垒(活化能)为201.1kJ·mol-1
D .
NO2+H2O
B . 反应历程中还可能形成HONO···H2O
C . 该反应历程中最大能垒(活化能)为201.1kJ·mol-1
D . O-O键 |
|
| O2 |
|
键长/(×10-12 m) | 149 | 128 | 121 | 112 |
键能/(kJ·mol-1) | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律推导出键能的大小顺序为w>z>y>x,则该规律是( )
-
(1) Z在周期表中的位置,五种元素中原子半径最大的是(填元素符号)。
-
(2) Y元素最高价氧化物的电子式,其空间结构为形。
-
(3) 由X、Z、W的两种或三种元素形成的化合物中既含极性键又含非极性键的是(填结构式);既含离子键又含非极性共价键的是(填电子式)。
-
(4) Y、Z的最简单气态氢化物中热稳定性较差的是(填化学式)。
-
(5) 工业上用单质R制漂白粉的化学方程式是。
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径/nm |
0.074 |
0.160 |
0.152 |
0.110 |
0.099 |
0.186 |
0.075 |
0.082 |
|
最高正化合价 |
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
|
最低负化合价 |
-2 |
-3 |
-1 |
-3 |
-
(1) ⑧号元素在元素周期表中的位置是。
-
(2) ①④⑦元素的简单气态氢化物中,稳性定由高到低排序(写化学式)。
-
(3) 写出⑦组成的10电子微粒阳离子的电子式,并用电子式表示由②⑤组成的盐的形成过程。
-
(4) 结合原子结构解释③⑥元素的最高价氧化物对应的水化物的碱性强弱。
-
(5) 含锂材料在社会中应用广泛,如各种储氢材料(
 等)、便携式电源材料(
等)、便携式电源材料( 等),根据下列要求回答问题:
等),根据下列要求回答问题:
①
 和
和 可作核反应堆最佳热载体,
可作核反应堆最佳热载体, 和
和 用作高温堆减速剂。下列说法正确的是(填字母,下同)。
用作高温堆减速剂。下列说法正确的是(填字母,下同)。A.
 和
和 互为同位素 B.
互为同位素 B. 和
和 属于同种核素
属于同种核素C.
 和
和 中电子总数相同 D.
中电子总数相同 D. 和
和 是同种物质
是同种物质②实验室中锂为避免接触空气保存在中;锂电池使用时需要注意防水,其原因用离子反应方程式表示为。
③下列说法不正确的是。
A.金属性:

B.碱性:

C.半径:

D.氧化性:

 C . NaOH的电子式:
C . NaOH的电子式:





