第一章 物质及其变化 知识点题库
 中的几种,请填写下列空白:
中的几种,请填写下列空白:
-
(1) 不用做任何实验就可以肯定原溶液中不存在的离子是。
-
(2) 取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是。
-
(3) 取(2)中滤液,加入过量的氢氧化钠溶液,出现白色沉淀,说明原溶液中肯定有,写出加入氢氧化钠溶液发生的离子方程式:,。
-
(4) 原溶液中可能大量存在的阴离子是___(填字母)。A . Cl- B . NO
 C . CO
C . CO 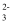 D . OH-
D . OH-
 、NO
、NO  。现进行如下检验:
。现进行如下检验:
-
(1) 不用做任何实验,就可以排除的离子是
-
(2) 用红色石蕊试纸检验,试纸变蓝色,可确定溶液中一定存在的离子是,同时排除的离子是
-
(3) 另取少量溶液逐滴滴加盐酸至过量,无气体放出,由此可以确定溶液中无
-
(4) 另取少量溶液用硝酸酸化后,加入AgNO3溶液有白色沉淀生成,写出反应的离子方程式
②CuSO4溶液和BaCl2溶液混合,反应的离子方程式为,恰好反应后,过滤后溶液的溶质为(填化学式)。
 ,下列说法正确的是( )
,下列说法正确的是( )
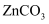 在反应中失去电子
C . 还原剂与氧化剂的物质的量之比为1∶2
D . 氧化产物与还原产物的物质的量之比为1∶1
在反应中失去电子
C . 还原剂与氧化剂的物质的量之比为1∶2
D . 氧化产物与还原产物的物质的量之比为1∶1

-
(1) 沸腾炉中发生反应的化学方程式为4FeS2+11O2
 2Fe2O3+8SO2 , 该反应被氧化的元素是(填元素名称)。
2Fe2O3+8SO2 , 该反应被氧化的元素是(填元素名称)。
-
(2) 利用Fe2O3废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的化学方程式为。
-
(3) 从接触室出来的混合气体中含有SO2、SO3、O2、N2等气体,设计一个实验方案证明其中含有SO2:。
-
(4) 有些反应中物质浓度不同,性质也不同。浓硫酸有三大特性:吸水性、脱水性、强氧化性。则加热时浓硫酸与木炭反应的化学方程式为。
-
(5) 将一定量锌与100mL18mol/L 浓硫酸充分反应后,若锌完全溶解同时产生气体0.8mol, 将反应后的溶液稀释得400mL,测得c(H+)=2mol/L,则产生气体中SO2 物质的量为mol。
 B . 乙醇在铜催化下氧化:
B . 乙醇在铜催化下氧化:  C . 氯化铵水解的离子方程式:
C . 氯化铵水解的离子方程式: 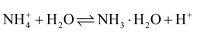 D . 碳酸氢钠在水中的电离方程式:
D . 碳酸氢钠在水中的电离方程式: 
 B . Cu
C .
B . Cu
C .  D .
D . 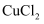
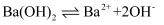 B . 钢铁发生吸氧腐蚀时的正极反应:
B . 钢铁发生吸氧腐蚀时的正极反应: 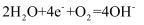 C . Na2S水解的离子方程式:
C . Na2S水解的离子方程式: 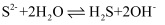 D . 电解NaCl溶液的离子方程式:
D . 电解NaCl溶液的离子方程式: 
 ,还含有
,还含有 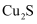 、
、 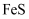 等)。一种以黝锡矿为原料提取锡的工艺流程如图所示:
等)。一种以黝锡矿为原料提取锡的工艺流程如图所示: 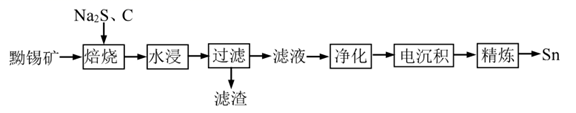
已知:“滤液”中含有的主要离子为 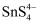 、
、 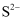 、
、  等。
等。
回答下列问题:
-
(1) “焙烧”过程中主要发生的反应为
 。
。 ①
 中
中 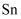 元素的化合价为。
元素的化合价为。②在反应物中加入
 粉的最主要目的是(填标号)。
粉的最主要目的是(填标号)。A.提供能量 B.防止
 被氧化 C.防止结块
被氧化 C.防止结块③加入的
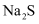 的量应为黝锡矿量的2.1倍,结合图示说明其原因。
的量应为黝锡矿量的2.1倍,结合图示说明其原因。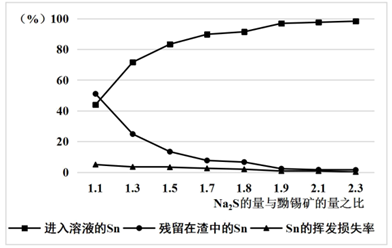
-
(2) “滤渣”中可回收的金属是(填元素符号)。
-
(3) 若黝锡矿中含有
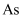 元素,则“净化”时需加入
元素,则“净化”时需加入 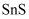 ,将
,将  转化为单质
转化为单质 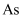 除去,发生反应的离子方程式为
除去,发生反应的离子方程式为  ,该过程可看作经历以下两步反应:
,该过程可看作经历以下两步反应: 第一步:

第二步:
-
(4) “电沉积”时,采用惰性电极作阳极,纯锡作阴极,
 溶液和“净化”后溶液(主要含
溶液和“净化”后溶液(主要含 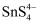 、
、  等)分别为两极区的电解液,选用阳离子交换膜。
等)分别为两极区的电解液,选用阳离子交换膜。 ①“净化”后溶液应作(填“阳极区”或“阴极区”)电解液。
②“电沉积”过程中,阳极区溶液的
 (填“增大”或“减小”或“不变”)。
(填“增大”或“减小”或“不变”)。③“电沉积”结束后,阴极区溶液的主要溶质为(填化学式)。
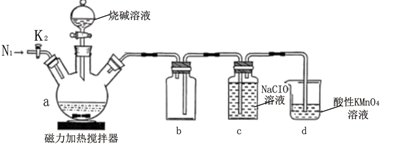
回答下列问题:
-
(1) 在a中加入黄磷、活性炭粉末,打开K1 , 通入N2一段时间,关闭K1 , 打开磁力加热搅拌器,滴加烧碱溶液。
①活性炭粉末作为黄磷的分散剂,目的是
②a中反应的化学方程式为
-
(2) 反应结束后,打开K1 , 继续通入N2 , 目的是d的作用是
-
(3) c中生成 NaH2PO2和NaCl,c中反应的离子方程式为;相关物质溶解度(S)如下:
s(25℃ )
s(100℃ )
NaCl
37
39
NaH2PO2
100
667
充分反应后,将a、c中溶液混合,将混合液(含极少量NaOH)蒸发浓缩,有大量晶体析出,该晶体主要成分的化学式为,然后,再冷却结晶、过滤、洗涤、干燥,得到含NaH2PO2的粗产品。
-
(4) 产品纯度测定:
取产品1.50克配成250mL溶液,取25mL于锥形瓶中,酸化后加入25mL,0.10mol/L碘水,于暗处充分反应后,以淀粉溶液做指示剂,用0.10 mol/L Na2S2O3溶液滴定至终点,平均消耗18.00mL,相关反应方程式为:H2PO
 +H2O+I2=H2PO
+H2O+I2=H2PO  +2H++2I- , 2S2O
+2H++2I- , 2S2O  +I2=S4O
+I2=S4O  +2I-。产品纯度为
+2I-。产品纯度为
 的NaHSO3溶液中,
的NaHSO3溶液中, B .
B . 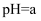 的醋酸或盐酸分别稀释10倍的pH均为
的醋酸或盐酸分别稀释10倍的pH均为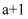 C .
C . 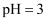 的盐酸与
的盐酸与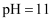 的氨水以任意比例混合后,溶液中
的氨水以任意比例混合后,溶液中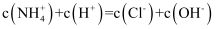 D . 向
D . 向 的氨水中加入少量水,溶液中
的氨水中加入少量水,溶液中 减小
减小
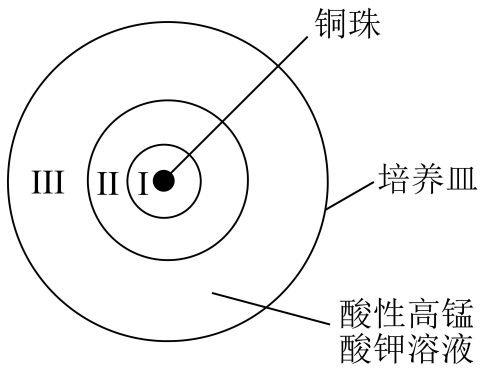
实验 | 现象 |
| 一段时间后,培养皿中由铜珠向外侧依次呈现: Ⅰ区澄清且紫色褪色明显 Ⅱ区底部覆盖棕黑色固体 Ⅲ区澄清且紫色变浅 |
已知:MnO2是棕黑色固体。下列说法不正确的是( )
 +16H+=5Cu2++2Mn2++8H2O
B . Ⅱ区棕黑色固体是由铜和酸性高锰酸钾反应产生还原产物
C . Ⅲ区紫色变浅说明在Ⅲ区MnO
+16H+=5Cu2++2Mn2++8H2O
B . Ⅱ区棕黑色固体是由铜和酸性高锰酸钾反应产生还原产物
C . Ⅲ区紫色变浅说明在Ⅲ区MnO 的浓度减小,是因为离子扩散作用
D . 如果酸性高锰酸钾过量很多,所有反应完全后,产物中可能没有Mn2+
的浓度减小,是因为离子扩散作用
D . 如果酸性高锰酸钾过量很多,所有反应完全后,产物中可能没有Mn2+
化学式 | CH3COOH | H2CO3 | H2SO3 |
Ka | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.0×10-7 |
下列说法正确的是( )
 )+c(HSO
)+c(HSO )+2c(CO
)+2c(CO )+c(HCO
)+c(HCO )-0.1
B . 25℃时,0.1mol·L-1Na2SO3溶液的pH约等于10(忽略二级水解和H2O的电离)
C . 25℃时,0.1mol·L-1CH3COONa溶液中通入HCl气体,至pH=7(溶液体积变化忽略不计):c(Na+)>c(Cl-)>c(CH3COOH)
D . 足量CH3COOH与Na2SO3溶液反应的化学方程式为:2CH3COOH+Na2SO3=2CH3COONa+SO2↑+H2O
)-0.1
B . 25℃时,0.1mol·L-1Na2SO3溶液的pH约等于10(忽略二级水解和H2O的电离)
C . 25℃时,0.1mol·L-1CH3COONa溶液中通入HCl气体,至pH=7(溶液体积变化忽略不计):c(Na+)>c(Cl-)>c(CH3COOH)
D . 足量CH3COOH与Na2SO3溶液反应的化学方程式为:2CH3COOH+Na2SO3=2CH3COONa+SO2↑+H2O
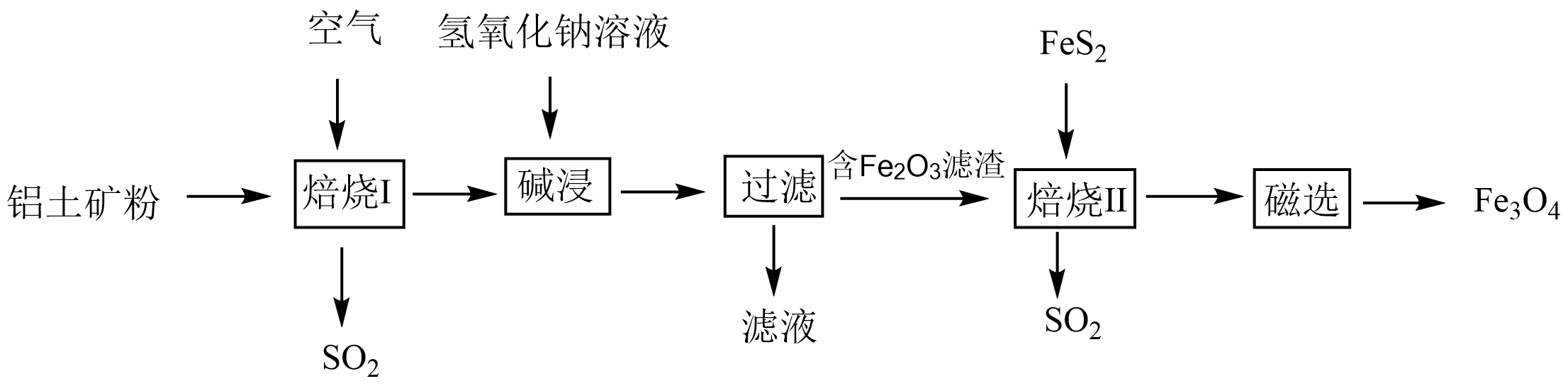
下列说法正确的是( )
 +H2O
C . 滤液中通入足量CO2 , 过滤后可得到Al2O3
D . 无氧条件下进行“焙烧II”时,理论上消耗的n(FeS2):n(Fe2O3)=1:16
+H2O
C . 滤液中通入足量CO2 , 过滤后可得到Al2O3
D . 无氧条件下进行“焙烧II”时,理论上消耗的n(FeS2):n(Fe2O3)=1:16
 与
与  溶液的反应。
溶液的反应。
-
(1) 实验一:用如图所示实验装置制备
 ,并将足量
,并将足量  通入
通入  溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。
溶液中,溶液迅速变为血红色;停止通入气体,将血红色溶液密闭放置5小时后,溶液变为浅绿色。 
制备
 的化学反应方程式为;
的化学反应方程式为; -
(2) 仪器a的名称为,按图示装好药品后,打开K之前的操作是。
-
(3) 某同学取适量酸性
 于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有Fe2+。此结论(填“正确”、“不正确”),理由是。
于试管中,滴入几滴血红色溶液,溶液的紫色褪去,据此推断血红色溶液中含有Fe2+。此结论(填“正确”、“不正确”),理由是。
-
(4) 实验二:探究血红色溶液产生的原因
实验过程如下表:
实验序号
假设
实验内容
结论
①
与溶液中c(H+)有关
取适量上述血红色溶液,滴入Y溶液,溶液又变为黄色
假设不成立
②
与c(H2SO3)或c(SO2)有关
1溶液中,滴入1mol/LNaHSO3溶液,溶液呈血红色,再逐滴滴入HCl溶液,出现×××现象
假设不成立
③
与c(
 )或c(
)或c(  )有关
)有关在FeCl3溶液中加入Na2SO3溶液,立即变为血红色。
实验①中,Y是(填化学式);实验②中现象是;实验③的结论是。
-
(5) 为了进—步探究血红色物质产生主要原因,又进行了以下实验:
在0.5mL1mol/L的FeCl3溶液中,加入浓度相同的Na2SO3溶液V1mL,NaHSO3溶液V2mL并混合均匀,改变V1、V2的值并维持V1+V2=4.0进行多组实验,测得混合溶液的吸光度与
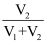 的关系如图所示。(已知吸光度越大,溶液颜色越深)。
的关系如图所示。(已知吸光度越大,溶液颜色越深)。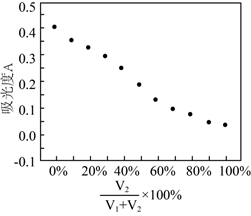
①维持V1+V2=4.0的目的是。
②该实验得出的结论是。