第一章 物质及其变化 知识点题库
-
(1) 明胶溶于水所形成的分散系和K2SO4溶液共同具备的性质是。
a.都不稳定,密封放置沉淀 b.两者均有丁达尔现象 c.分散质粒子可通过滤纸
-
(2) 现需配制0.50mol·L-1 K2SO4溶液480mL。
①配制溶液时必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、、、以及等质量的几片滤纸。
②配制该溶液需称取K2SO4晶体的质量为。
③下列关于容量瓶的使用方法中,正确的是。
A.容量瓶可长期存放溶液 B.在容量瓶中直接溶解固体
C.溶液未经冷却即注入容量瓶中 D.向容量瓶中转移溶液要用玻璃棒引流
④下列操作会使所配溶液浓度偏低的是。
A.转移溶液时有液体溅出
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C.定容时俯视刻度线
D.烧杯和玻璃棒未洗涤
-
(3) 现有下列十种物质:①HCl;②NaHCO3;③K2SO4溶液;④CO2;⑤蔗糖晶体;⑥Ca(OH)2;⑦氢氧化铁胶体;⑧NH3·H2O;⑨空气;⑩Al2(SO4)3
(a)上述物质中属于电解质的有,非电解质的有(填序号)。
(b)CO2属于酸性氧化物,SiO2也属于酸性氧化物,请写出SiO2和CaO反应的化学方程式:。
(c)②在水溶液中的电离方程式为。
(d)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:;如果病人同时患胃溃疡,为防胃壁穿孔,不宜服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式:。
(e)若⑦中混有少量的③,提纯的方法是:。
A.蒸馏(分馏)
B.萃取
C.渗析
D.分液

-
(1) “拆解”前需进入“放电”处理的目的是;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有。
-
(2) 上述流程中将CoO
 转化为Co3+的离子方程式为 。
转化为Co3+的离子方程式为 。
-
(3) 滤液1中加入Na2SO3的主要目的是;加入NaClO3的主要目的是 。
-
(4) “沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据上图分析:沉钴时应控制n(C2O
 ):n(Co2+)比为,温度控制在℃左右。
):n(Co2+)比为,温度控制在℃左右。
-
(1) 元素B在周期表中的位置;
-
(2) C2A4的结构式为:,用电子式表示E2D的形成过程:。
-
(3) C、D、E形成的简单离子的半径由大到小的顺序为:。(用离子符号表示)
-
(4) E的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物之间发生的化学反应方程式为:。
-
(5) 向KI溶液中通入适量的F单质后,再滴加一定量的CCl4 , 振荡静置后,继续通入F单质并充分振荡,混合溶液逐渐变为无色,若1mol还原剂转移10NA电子,上述反应的化学方程式为:。
 在一定条件下可以发生如图转化关系,下列说法错误的是( )
在一定条件下可以发生如图转化关系,下列说法错误的是( ) 
 > I2
B . 用淀粉碘化钾试纸和白醋可检验食盐是否加碘
C . 生产等量的碘,反应①和反应②转移电子数目之比为2∶5
D . 反应③的离子方程式:3Cl2+ I-+3H2O →6Cl- + IO
> I2
B . 用淀粉碘化钾试纸和白醋可检验食盐是否加碘
C . 生产等量的碘,反应①和反应②转移电子数目之比为2∶5
D . 反应③的离子方程式:3Cl2+ I-+3H2O →6Cl- + IO  +6H+
+6H+

-
(1) 形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为,Ni(CO)4含有的化学键类型。
-
(2) Ni2O3有强氧化性,加压酸浸时,有气体产生且镍被还原为Ni2+ , 则产生的气体为(填化学式)。
-
(3) 滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体生成单质镍的离子方程式:。
-
(4) “高温熔融”时通入氩气的目的是。
-
(5) 检验滤液C中金属阳离子的试剂是(填标号)。
a.KSCN溶液 b.K3[Fe(CN)6] c.酸性高锰酸钾 d.苯酚
-
(6) 碱浸的目的是使镍铝合金产生多孔结构,其原理(用化学方程式表示)。
 、
、  、
、 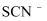 、
、  B .
B .  的溶液:
的溶液:  、
、  、
、 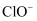 、
、  C . 水电离的
C . 水电离的 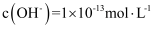 的溶液中:
的溶液中:  、
、  、
、  、
、  D .
D .  的
的  溶液:
溶液:  、
、  、
、  、
、 
 、
、  、
、  B .
B .  、
、  、
、  C .
C .  、
、  、
、  D .
D .  、
、  、
、 

-
(1) 盛装浓盐酸的仪器名称是。
-
(2) 装置A烧瓶中反应的化学方程式为。
-
(3) 装置D中Cl2与试剂B反应的离子方程式为。
-
(4) E中最好选用试剂为(填标号),其作用是。
A.Na2SO4溶液 B.浓H2SO4 C.饱和NaCl溶液 D.NaOH溶液
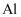 反应有气体生成的溶液中:
反应有气体生成的溶液中: 、
、 、
、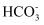 、
、 B . 由水电离出
B . 由水电离出 的溶液中:
的溶液中: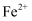 、
、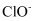 、
、 、
、 C .
C .  的溶液中:
的溶液中: 、
、 、
、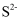 ,
,  D . 滴加
D . 滴加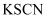 溶液显红色的溶液中:
溶液显红色的溶液中: 、
、 、
、 、
、
-
(1) 写出H2O2的结构式:。
Fe3+可用作H2O2分解的催化剂,反应的机理为:
①Fe3++ H2O2=Fe2++H++·OOH
②H2O2+X=Y+Z+W
③Fe2++·OH=Fe3++OH-
④H++OH-=H2O
根据上述机理推导步骤②中的化学方程式为。
-
(2) ①H2O2是一种二元弱酸,它与少量的Ba (OH)2反应的化学方程式为。
②H2O2还能使酸性KMnO4溶液褪色,写出反应的离子方程式。
-
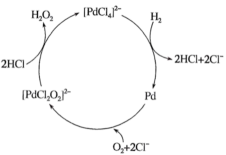
(3) 现一种制备H2O2的一种工艺简单、能耗低的方法,反应原理如图所示,该制备反应的总反应方程式为。
-
(4) 科学家对H2O2分子结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
甲:
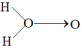 、乙:H−O−O−H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:
、乙:H−O−O−H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5) 2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式):。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d, 请设计d的实验方案。



