第一章 物质及其变化 知识点题库
-
(1) 化学与生产生活密切相关,请写出下列反应
①实验室制氯气(离子方程式)
②“腐蚀法”制作印刷电路板(化学方程式)并用双线桥表示该反应的电子转移数目和方向
-
(2) K2FeO4可用作水处理剂,它可由以下反应制得:
Cl2 + Fe(OH)3 + OH- = FeO4 2-+ Cl- + H2O
配平此反应方程式。当1mol K2FeO4生成时,转移的电子数目为
常温时,下列事实一定能证明HA是弱酸的是( )
A . 用HA溶液做导电实验,灯泡很暗
B . HA和CaCO3发生反应放出CO2
C . pH=2的HA溶液稀释至100倍,pH小于4
D . pH=3的HA溶液中水电离出的c(H+)为10-11mol·L-1
某无色酸性溶液中一定能大量共存的离子组是( )
A . Na+、 Ba2+、Cl-、  B .
B .  、OH-、Al3+、Mg2+
C . Cl-、 Fe3+、K+、 Na+
D . Na+、 K+、
、OH-、Al3+、Mg2+
C . Cl-、 Fe3+、K+、 Na+
D . Na+、 K+、  、Cl-
、Cl-
 B .
B .  、OH-、Al3+、Mg2+
C . Cl-、 Fe3+、K+、 Na+
D . Na+、 K+、
、OH-、Al3+、Mg2+
C . Cl-、 Fe3+、K+、 Na+
D . Na+、 K+、  、Cl-
、Cl-
能正确表示下列反应的离子方程式是( )
A . 氢氧化铁溶于氢碘酸(强酸):Fe(OH)3+3H+=Fe3++3H2O
B . 碳酸钠溶液水解:  +H3O+
+H3O+ 
 +H2O
C . Na2SiO3溶液与醋酸混合:
+H2O
C . Na2SiO3溶液与醋酸混合:  +2H+= H2SiO3↓
D . 0.2mol∙L-1KAl(SO4)2与0.3mol∙L-1Ba(OH)2溶液等体积混合:2Al3++3
+2H+= H2SiO3↓
D . 0.2mol∙L-1KAl(SO4)2与0.3mol∙L-1Ba(OH)2溶液等体积混合:2Al3++3  +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
 +H3O+
+H3O+ 
 +H2O
C . Na2SiO3溶液与醋酸混合:
+H2O
C . Na2SiO3溶液与醋酸混合:  +2H+= H2SiO3↓
D . 0.2mol∙L-1KAl(SO4)2与0.3mol∙L-1Ba(OH)2溶液等体积混合:2Al3++3
+2H+= H2SiO3↓
D . 0.2mol∙L-1KAl(SO4)2与0.3mol∙L-1Ba(OH)2溶液等体积混合:2Al3++3  +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
下列各氧化还原反应的化学方程式表示的变化过程正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
向一定浓度的氨水与氢氧化钠混合液中滴加醋酸,溶液导电能力如图所示,下列说法正确的是( )

A .  段,导电能力下降是由于溶液总体积变大
B .
段,导电能力下降是由于溶液总体积变大
B . 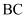 段,发生反应的离子方程式为
段,发生反应的离子方程式为  C .
C . 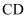 段,导电能力下降是由于溶液中离子个数在减少
D . 随着醋酸的滴加,最终溶液导电性又将增大
段,导电能力下降是由于溶液中离子个数在减少
D . 随着醋酸的滴加,最终溶液导电性又将增大
 段,导电能力下降是由于溶液总体积变大
B .
段,导电能力下降是由于溶液总体积变大
B . 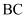 段,发生反应的离子方程式为
段,发生反应的离子方程式为  C .
C . 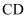 段,导电能力下降是由于溶液中离子个数在减少
D . 随着醋酸的滴加,最终溶液导电性又将增大
段,导电能力下降是由于溶液中离子个数在减少
D . 随着醋酸的滴加,最终溶液导电性又将增大
氧化还原反应是一类重要的反应。
-
(1) 已知反应:①Cu+2Fe3+=Cu2++2Fe2+ , ②Cu2++Fe=Cu+Fe2+ , 两个反应中各种离子的氧化性从强到弱的顺序是。
-
(2) 用双线桥法标出下列反应中电子转移的方向和数目Cl2+SO2+2H2O=H2SO4+2HCl。并指出氧化剂和还原剂:氧化剂,还原剂:。
-
(3) 已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。铜与稀硝酸反应的离子方程式是。
-
(4) 下列物质在氧化还原反应中,常作还原剂的有;常作氧化剂的有。(均填序号)
①KMnO4②铝③氯水④FeCl3⑤一氧化碳
NO2易溶于水,且能与水反应,下列有关NO2与水反应的说法中正确的是( )
A . 氮元素的化合价不发生变化
B . NO2既作氧化剂,又作还原剂
C . NO2只作氧化剂
D . NO2只作还原剂
下列过程不涉及氧化还原反应的是( )
A . 电解熔融氯化钠制金属钠
B . 用明矾净水
C . 用氯气制漂白粉
D . 粮食酿酒
CO2的转化一直是世界范围内的研究热点。利用两种金属催化剂,在水溶液体系中将CO2分别转化为CO和HCOOH的反应过程示意图如下:
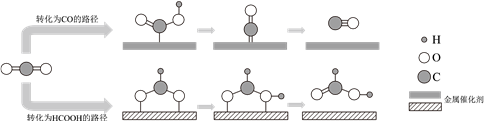
下列说法正确的是( )
A . 在转化为CO的路径中,只涉及碳氧键的断裂和氧氢键的形成
B . 在转化为HCOOH的路径中,CO2被氧化为HCOOH
C . 在转化为两种产物的过程中碳、氧原子的利用率均为100%
D . 上述反应过程说明催化剂具有选择性
下列说法正确的是( )
A . NO2溶于水能生成硝酸
B .  的空间构型为三角锥形
C . N2O4制取HNO3是利用了N2O4的氧化性
D . 常温下可用铝制容器盛装稀硝酸
的空间构型为三角锥形
C . N2O4制取HNO3是利用了N2O4的氧化性
D . 常温下可用铝制容器盛装稀硝酸
 的空间构型为三角锥形
C . N2O4制取HNO3是利用了N2O4的氧化性
D . 常温下可用铝制容器盛装稀硝酸
的空间构型为三角锥形
C . N2O4制取HNO3是利用了N2O4的氧化性
D . 常温下可用铝制容器盛装稀硝酸
除去FeCl3溶液中混有的少量FeCl2 , 可以向此溶液中通入过量的氯气,发生如下反应:2FeCl2+Cl2=2FeCl3。对于该反应说法正确的是( )
A . 属于氧化还原反应
B . 属于复分解反应
C . Cl2作还原剂
D . Fe2+被还原
下列物质的水溶液因电离而呈酸性的是( )
A . NaCl
B . NH4Cl
C . NaHCO3
D . NaHSO4
已知生理盐水中NaCl的质量分数为0.9%,某一瓶500mL运动饮料标签的部分内容如图,有关这瓶饮料,下列说法错误的是( )

A . 葡萄糖是非电解质
B . NaCl的质量分数比生理盐水小
C . MgSO4的物质的量浓度小于5×10-4mol/L
D . Ca2+的物质的量在6×10-5~1.2×10-4mol之间
下列关于氧化还原反应的说法中正确的是( )
A . 氧化还原反应前后元素化合价有升降
B . 氧化还原反应前后一定有氧的得失
C . Fe3+→Fe2+的变化过程中,Fe元素发生氧化反应
D . 物质所含元素化合价升高的反应是还原反应
目前,汽车尾气系统中均安装催化转化器。在催化转化器中发生反应 2NO+2CO  2CO2+N2该反应中氧化剂是( )
2CO2+N2该反应中氧化剂是( )
 2CO2+N2该反应中氧化剂是( )
2CO2+N2该反应中氧化剂是( )
A . NO
B . N2
C . CO2
D . CO
下列各式中,属于正确的水解反应方程式是( )
A . NH  + 2H2O
+ 2H2O  NH3·H2O+ H3O+
B . CO
NH3·H2O+ H3O+
B . CO  + 2H2O
+ 2H2O  H2CO3 + 2OH-
C . CH3COOH + OH-
H2CO3 + 2OH-
C . CH3COOH + OH-  CH3COO- +H2O
D . CH3COOH+ H2O
CH3COO- +H2O
D . CH3COOH+ H2O  CH3COO- +H3O+
CH3COO- +H3O+
 + 2H2O
+ 2H2O  NH3·H2O+ H3O+
B . CO
NH3·H2O+ H3O+
B . CO  + 2H2O
+ 2H2O  H2CO3 + 2OH-
C . CH3COOH + OH-
H2CO3 + 2OH-
C . CH3COOH + OH-  CH3COO- +H2O
D . CH3COOH+ H2O
CH3COO- +H2O
D . CH3COOH+ H2O  CH3COO- +H3O+
CH3COO- +H3O+
回答下列问题:
-
(1) 在下列物质中,可以导电的是(填序号,下同),是电解质的有。
①干燥的氯化钠晶体 ②干燥的氢氧化钠固体 ③蔗糖晶体 ④酒精
⑤NaHSO4溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧Ba(OH)2溶液
-
(2) 向盛有⑧的溶液中,逐滴加入⑤,当溶液中的Ba2+恰好完全沉淀时,发生反应的离子方程式为。
-
(3) 工业上利用电解①的饱和溶液制Cl2 , 发生反应的化学方程式为。
-
(4) 某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、
 、
、 、
、 现进行如下实验:
现进行如下实验:①用红色石蕊试纸检验,试纸变蓝色。
②另取少量溶液逐滴滴加盐酸至过量,有气体放出,再加入BaCl2溶液后,没有沉淀生成。
③另取少量溶液用足量硝酸酸化后,加入AgNO3溶液有白色沉淀生成。
根据上述实验推断:原溶液中肯定有离子,肯定没有离子。
回答下列问题:
-
(1) 氯酸钾和浓盐酸之间有下列反应:
 。该反应中发生还原反应的物质是(填化学式。下同),氧化产物是;用双线桥标出方程式中的电子的转移情况:。
。该反应中发生还原反应的物质是(填化学式。下同),氧化产物是;用双线桥标出方程式中的电子的转移情况:。
-
(2)
 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钾(
可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钾( ),氧化性比Cl2、O2、ClO2、
),氧化性比Cl2、O2、ClO2、 还强,主要反应:
还强,主要反应: 。
。①上述反应中作还原剂的是(填化学式)。
②简要说明
 作为水处理剂时所起的作用(写出一点即可)。
作为水处理剂时所起的作用(写出一点即可)。③在上述反应过程中可生成一种
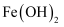 白色沉淀,该沉淀极易被空气中的氧气氧化,反应的化学方程式为
白色沉淀,该沉淀极易被空气中的氧气氧化,反应的化学方程式为 (红褐色沉淀),该反应属于四大基本反应中的(填反应类型名称),每当有1 mol O2参与反应转移的电子数为个。
(红褐色沉淀),该反应属于四大基本反应中的(填反应类型名称),每当有1 mol O2参与反应转移的电子数为个。
某未知溶液中只可能大量存在下列离子:Na+、Ba2+、CO 、SO
、SO 、Cl-、H+ , 为探究其组成,某实验小组进行了以下实验:
、Cl-、H+ , 为探究其组成,某实验小组进行了以下实验:
 、SO
、SO 、Cl-、H+ , 为探究其组成,某实验小组进行了以下实验:
、Cl-、H+ , 为探究其组成,某实验小组进行了以下实验:
-
(1) 写出“沉淀2”的化学式;
-
(2) “沉淀1”与稀盐酸反应的离子方程式为;
-
(3) 原溶液中一定大量存在的离子是,一定不存在的离子是可能存在的离子是。
最近更新



