第一章 物质及其变化 知识点题库
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A . 1.0mol/LKNO3溶液:H+、Fe2+、SCN-、SO42-
B . pH =0的溶液:Al3+、CO32-、Cl-、SO42-
C .  的溶液:K+、Ba2+、NO3-、Cl-
D . 无色溶液:Na+、SO32-、Cu2+、SO42-
的溶液:K+、Ba2+、NO3-、Cl-
D . 无色溶液:Na+、SO32-、Cu2+、SO42-
 的溶液:K+、Ba2+、NO3-、Cl-
D . 无色溶液:Na+、SO32-、Cu2+、SO42-
的溶液:K+、Ba2+、NO3-、Cl-
D . 无色溶液:Na+、SO32-、Cu2+、SO42-
有关物质的转化关系如下图所示(部分物质和条件已略去)。B、C、E是常见气体;A、Ⅹ、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色。

请回答下列问题:
-
(1) A的原子结构示意图为;
-
(2) 写出气体C的一种用途;
-
(3) Y和D溶液反应的离子方程式为;
-
(4) 实验室检验Ⅰ中所含的金属阳离子的试剂是(填化学式);
-
(5) Ⅰ溶液常用于腐蚀印刷电路铜板,请写出相关的离子方程式。
下列离子方程式正确的是( )
A . 甘氨酸与氢氧化钠溶液反应:H2NCH2COOH+NaOH→H2NCH2COO-+Na++H2O
B . 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-=Al2(CO3)3↓
C . 苯酚溶液中加入少量纯碱溶液:2C6H5OH+CO32-→2C6H5O-+H2O+CO2
D . 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=NO3-+NO2-+H2O
不能正确表示下列变化的离子方程式是( )
A . 氧化镁与盐酸反应:MgO+2H+=Mg2++H2O
B . 氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
C . 将过量CO2通入NaAlO2溶液中:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D . 氯化铵水解:NH4++H2O  NH3·H2O+H+
NH3·H2O+H+
 NH3·H2O+H+
NH3·H2O+H+
下列物质中,其水溶液能导电,但自身属于非电解质的是( )
A . CH3COOH
B . Na2O
C . H2SO4
D . SO2
下列物质分类正确的组合是( )
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 空气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
A . A
B . B
C . C
D . D
下列转化中,需要加入还原剂才能实现的是( )
A . Na → NaOH
B . HCO  → CO2
C . Fe3+ → Fe2+
D . Cl- → Cl2
→ CO2
C . Fe3+ → Fe2+
D . Cl- → Cl2
 → CO2
C . Fe3+ → Fe2+
D . Cl- → Cl2
→ CO2
C . Fe3+ → Fe2+
D . Cl- → Cl2
现有下列十种物质:①H2、②铝、③CaO、④CO2、⑤H2SO4、⑥Ba(OH)2、⑦红褐色的氢氧化铁澄清液体、⑧氨水、⑨稀硝酸、⑩Al2(SO4)3
-
(1) 上述各物质按物质的分类方法填写表格的空白处(填物质编号):
分类标准
金属单质
氧化物
溶液
胶体
电解质
属于该类的物质
-
(2) 上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程式为。
-
(3) 少量的④通入⑥的溶液中反应的离子方程式为。
-
(4) 白色沉淀变成灰绿色再变成红褐色沉淀的化学方程式:。
下列物质能导电且又属于电解质的是( )
A . Al
B . 熔融态NaCl
C . 蔗糖
D . 盐酸
下列物质分类的正确组合是( )
| 选项 | 混合物 | 纯净物 | 单质 | 电解质 |
| A | 盐酸 | NaOH | 石墨 | K2SO4溶液 |
| B | 空气 | Fe(OH)3胶体 | 铁 | Na2CO3 |
| C | CuSO4·5H2O | CaCl2 | 水银 | 铜 |
| D | 氨水 | KNO3晶体 | O3 | NaCl |
A . A
B . B
C . C
D . D
下列反应中,  表现出氧化性的是( )
表现出氧化性的是( )
 表现出氧化性的是( )
表现出氧化性的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
向 和
和 的混合溶液中加入铁粉,其固体质量的变化如图所示,下列说法中正确的是(已知氧化性:
的混合溶液中加入铁粉,其固体质量的变化如图所示,下列说法中正确的是(已知氧化性: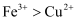 )( )
)( )
 和
和 的混合溶液中加入铁粉,其固体质量的变化如图所示,下列说法中正确的是(已知氧化性:
的混合溶液中加入铁粉,其固体质量的变化如图所示,下列说法中正确的是(已知氧化性: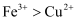 )( )
)( )
A . 原混合溶液中 B .
B .  点溶液中
点溶液中 C .
C .  点溶液呈蓝色
D . 若不考虑溶液体积变化,
点溶液呈蓝色
D . 若不考虑溶液体积变化, 、
、 、
、 三点溶液中
三点溶液中 浓度相同
浓度相同
 B .
B .  点溶液中
点溶液中 C .
C .  点溶液呈蓝色
D . 若不考虑溶液体积变化,
点溶液呈蓝色
D . 若不考虑溶液体积变化, 、
、 、
、 三点溶液中
三点溶液中 浓度相同
浓度相同
在某澄清透明的酸性溶液中,能大量共存的离子组是( )
A .  、
、 、
、 、
、 B .
B .  、
、 、
、 、
、 C .
C .  、
、 、
、 、
、 D .
D .  、
、 、
、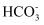 、
、
 、
、 、
、 、
、 B .
B .  、
、 、
、 、
、 C .
C .  、
、 、
、 、
、 D .
D .  、
、 、
、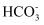 、
、
碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
|
化合物 |
Cr(OH)3 |
Ca(OH)2 |
Mg(OH)2 |
SrCO3 |
|
Ksp近似值 |
1×10-31 |
5.5×10-6 |
1.8×10-11 |
5.6×10-10 |
回答下列问题:
-
(1) 气体A的电子式为。
-
(2) “除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为(用离子方程式解释);“还原”时发生反应的离子方程式为。
-
(3) “滤渣1”的主要成分为(填化学式)。
-
(4) 用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为。
-
(5) “调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为。
-
(6) 已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11 , 则“碳化”时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=(保留两位有效数字)。
SrCO3(s)+H2CO3(aq)的平衡常数K=(保留两位有效数字)。
-
(7) “系列操作”中包含“200℃烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为 (填化学式)。
在含有大量漂粉精的溶液中,下列有关叙述正确的是( )
A . 加入K+、 、
、 、I-等离子,可以大量共存。
B . 可用pH试纸测定该溶液的pH
C . 向该溶液中滴加少量
、I-等离子,可以大量共存。
B . 可用pH试纸测定该溶液的pH
C . 向该溶液中滴加少量 溶液,反应的离子方程式为:
溶液,反应的离子方程式为: D . 该溶液中滴入一定量的浓盐酸,每产生
D . 该溶液中滴入一定量的浓盐酸,每产生 , 转移电子数约为
, 转移电子数约为 个
个
 、
、 、I-等离子,可以大量共存。
B . 可用pH试纸测定该溶液的pH
C . 向该溶液中滴加少量
、I-等离子,可以大量共存。
B . 可用pH试纸测定该溶液的pH
C . 向该溶液中滴加少量 溶液,反应的离子方程式为:
溶液,反应的离子方程式为: D . 该溶液中滴入一定量的浓盐酸,每产生
D . 该溶液中滴入一定量的浓盐酸,每产生 , 转移电子数约为
, 转移电子数约为 个
个
ICl与H2能发生的总反应为H2(g)+2ICl(g)=I2(g)+2HCl(g) △H<0。
已知:①该反应分两步完成,第一步为 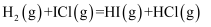
②两步反应的活化能分别为Ea1、Ea2 , 且Ea1>Ea2
下列判断正确的是( )
A . 总反应中I2为氧化产物
B . 第一步的化学反应速率大于第二步的化学反应速率
C . 已知键能:  ,可推知键能H-Cl<I-Cl
D . 第二步的化学方程式可能为
,可推知键能H-Cl<I-Cl
D . 第二步的化学方程式可能为 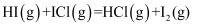
 ,可推知键能H-Cl<I-Cl
D . 第二步的化学方程式可能为
,可推知键能H-Cl<I-Cl
D . 第二步的化学方程式可能为 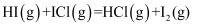
下列物质能导电的是( )
A . 乙醇溶液
B . 氯化钠溶液
C . 液态氯化氢
D . 氢氧化钠固体
硝酸厂烟气中含有大量氮氧化物(NOx)。常温下,将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中可实现无害化处理,其转化过程如图所示。下列说法正确的是( )

A . 反应Ⅰ的离子方程式为Ce4++H2=Ce3++2H+
B . 反应Ⅱ中氧化产物与还原产物的物质的量之比为2∶1
C . 该转化过程的实质是NO被H2氧化
D . 反应过程中混合溶液内Ce3+和Ce4+离子总数一定保持不变
化学上把外加少量酸、碱而pH基本不变的溶液,称为缓冲溶液。25℃时,浓度均为0.10 mol·Lˉ1的HCN与NaCN等体积混合所得缓冲溶液pH=9.4。下列说法错误的是( )
A . HCN的电离方程式为:HCN⇌H++CN-
B . HCN的电离程度大于CN-的水解程度
C . 向1.0 L上述缓冲溶液中滴加几滴NaOH稀溶液,溶液pH几乎不变
D . 溶液中各离子浓度大小关系为:c(Na+)>c(CN-)>c(OH-)>c(H+)
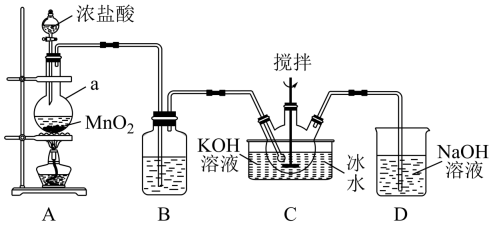
高铁酸钾( )为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,可用于饮用水处理。实验室中可通过如图方法制备
)为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,可用于饮用水处理。实验室中可通过如图方法制备 。
。
 )为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,可用于饮用水处理。实验室中可通过如图方法制备
)为暗紫色固体,是一种高效多功能的新型非氯绿色消毒剂,可用于饮用水处理。实验室中可通过如图方法制备 。
。
已知: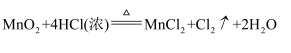
回答下列问题:
-
(1) Ⅰ.制备
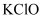 :
:仪器a的名称为;装置B中试剂的名称是;装置B的作用是。
-
(2) 装置C中
 与
与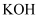 反应的离子方程式为。
反应的离子方程式为。
-
(3) 若无装置D,可能产生的危害是。
-
(4) Ⅱ.制备
 :
:待装置C中得到足量
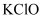 后,将三口烧瓶上的导管取下,依次加入适量
后,将三口烧瓶上的导管取下,依次加入适量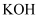 溶液、
溶液、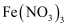 溶液并搅拌,控制水浴温度为
溶液并搅拌,控制水浴温度为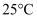 , 充分反应得到含有
, 充分反应得到含有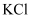 和
和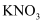 的紫色溶液,反应的离子方程式为。
的紫色溶液,反应的离子方程式为。
最近更新



