第一章 物质及其变化 知识点题库
-
(1) 下列五种物质中:①碘酒;②SO2;③H2SO4;④Al;⑤C6H6。其中属于单质的是(填序号,下同);属于酸性氧化物的是;属于有机化合物的是 。
-
(2) 1mol氢气在标准 状况下占有的体积约为L 。
-
(3) 写出氯气溶于水的化学方程式
反应方程式 Fe+CuSO4=FeSO4+Cu不属于下列反应类型中的( )
A . 离子反应
B . 氧化还原反应
C . 复分解反应
D . 置换反应
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
A . Na+、K+、OH-、Cl-
B . Na+、Cu2+ 、SO  、NO
、NO  C . Mg2+、Na+、SO
C . Mg2+、Na+、SO  、Cl-
D . Ca2+、HCO
、Cl-
D . Ca2+、HCO  、NO
、NO  、K+
、K+
 、NO
、NO  C . Mg2+、Na+、SO
C . Mg2+、Na+、SO  、Cl-
D . Ca2+、HCO
、Cl-
D . Ca2+、HCO  、NO
、NO  、K+
、K+
在碱性溶液中,R(OH)3能被ClO-氧化为  ,而ClO-被还原为Cl- , 已知R(OH)3、ClO-的反应个数比2:3,则
,而ClO-被还原为Cl- , 已知R(OH)3、ClO-的反应个数比2:3,则  中n等于( )
中n等于( )
 ,而ClO-被还原为Cl- , 已知R(OH)3、ClO-的反应个数比2:3,则
,而ClO-被还原为Cl- , 已知R(OH)3、ClO-的反应个数比2:3,则  中n等于( )
中n等于( )
A . 1
B . 2
C . 3
D . 4
当光束通过下列分散系时,能观察到丁达尔效应的是( )
A . 盐酸
B . Fe(OH)3胶体
C . 蔗糖溶液
D . Na2SO4溶液
-
(1) 多硫化钠(
 )是一系列含多硫离子的化合物,有
)是一系列含多硫离子的化合物,有  等,各原子均满足
等,各原子均满足  稳定结构,其中
稳定结构,其中  的电子式是。
的电子式是。
-
(2) 水因质子自递(
 )能导电,无水硫酸也能导电,其原因是(用化学用语表示)。
)能导电,无水硫酸也能导电,其原因是(用化学用语表示)。
-
(3) 青蒿素结构如图,只能在低温条件下萃取青滿索是因其分子中的某个基团对热不稳定,且该基团能与NaI反应生成
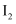 。该基团的结构式为。
。该基团的结构式为。 
某固体可能含有  、Cu2+、Na+、Cl-、
、Cu2+、Na+、Cl-、  、
、  中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
 、Cu2+、Na+、Cl-、
、Cu2+、Na+、Cl-、  、
、  中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离); ⑴一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63 g,在沉淀中加入过量稀盐酸,仍有4.66 g沉淀。
⑵另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672 L(标准状况)。
下列说法正确的是( )
A . 该固体中一定含有  、
、  、
、  、Na+
B . 该固体中一定没有Cu2+、可能含有Cl-、Na+
C . 该固体中只含有
、Na+
B . 该固体中一定没有Cu2+、可能含有Cl-、Na+
C . 该固体中只含有  、
、  、
、  、Cl-
D . 该固体中Na+的物质的量为0.03 mol
、Cl-
D . 该固体中Na+的物质的量为0.03 mol
 、
、  、
、  、Na+
B . 该固体中一定没有Cu2+、可能含有Cl-、Na+
C . 该固体中只含有
、Na+
B . 该固体中一定没有Cu2+、可能含有Cl-、Na+
C . 该固体中只含有  、
、  、
、  、Cl-
D . 该固体中Na+的物质的量为0.03 mol
、Cl-
D . 该固体中Na+的物质的量为0.03 mol
市场上某些免洗手消毒剂的主要成分之一是乙醇,按物质的组成和性质进行分类,乙醇属于( )
A . 单质
B . 氧化物
C . 烃
D . 有机物
当光束通过下列分散系时,能产生丁达尔效应的是( )
A . NaCl溶液
B . Fe(OH )3胶体
C . 盐酸
D . NaOH溶液
钠及其化合物的生产、应用是化工生产与研究的重要组成部分。
-
(1) 下列各项中属于保存金属钠的正确方法是_______。A . 放在棕色瓶中 B . 放在细沙中 C . 放在水中 D . 放在煤油中
-
(2) 钠是很活泼的金属,在空气中燃烧的产物是Na2O2 , Na2O的制取可以通过如下反应在密闭设备中完成:6Na+2NaNO2
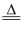 4Na2O+N2↑,请回答下列问题:
4Na2O+N2↑,请回答下列问题: ①不用钠在空气中氧化生成Na2O的原因是。
②在上述反应中,N2的作用是。
③该反应中的氧化剂是。
④在上述方程式中表示出电子转移的方向和数目。
下列离子方程式正确的是( )
A . 铁与稀盐酸反应:2Fe+6H+=2Fe3+ +3H2↑
B . 盐酸滴在石灰石上:CaCO3+2H+=Ca2+ +CO2↑+H2O
C . NH4HCO3溶液与足量 NaOH 溶液反应:NH4++OH- =NH3∙H2O
D . 氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
现有以下物质:①NaOH溶液;②液氨;③BaCO3固体,④熔融NaHSO4;⑤Fe(OH)3胶体:⑥铜;⑦CO2;⑧HClO;⑨蔗糖;⑩Na2O2。
-
(1) 以上物质中属于混合物的是(填序号),以上物质中属于电解质的是(填序号);以上纯净物中能导电的是(填序号)。
-
(2) 上述物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程式为。
-
(3) ⑩与水反应的离子反应方程式为。
 常用作有机合成的氯化剂,制备
常用作有机合成的氯化剂,制备 的反应为
的反应为 , 下列有关说法正确的是( )
, 下列有关说法正确的是( )
A . 基态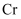 原子核外电子的运动状态共有15种
B .
原子核外电子的运动状态共有15种
B . 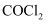 分子中碳原子不满足8电子稳定结构
C . 上述方程式中非金属元素的电负性:C<Cl
D . K原子的核外电子占据的最高能层的符号为M
分子中碳原子不满足8电子稳定结构
C . 上述方程式中非金属元素的电负性:C<Cl
D . K原子的核外电子占据的最高能层的符号为M
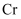 原子核外电子的运动状态共有15种
B .
原子核外电子的运动状态共有15种
B . 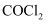 分子中碳原子不满足8电子稳定结构
C . 上述方程式中非金属元素的电负性:C<Cl
D . K原子的核外电子占据的最高能层的符号为M
分子中碳原子不满足8电子稳定结构
C . 上述方程式中非金属元素的电负性:C<Cl
D . K原子的核外电子占据的最高能层的符号为M
-
(1) Ⅰ如图所示,C、D、E和F均为惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。

直流电源为乙醇(
 )燃料电池,电解质溶液为
)燃料电池,电解质溶液为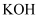 溶液,则B电极的电极反应式为。
溶液,则B电极的电极反应式为。 -
(2) 若甲中装有足量的硫酸铜溶液,工作一段时间后,停止通电,欲使溶液恢复到起始状态,可向溶液中加入____(填字母序号)。A .
 B .
B . 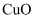 C .
C . 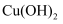 D .
D . 
-
(3) 欲用丙装置给铜镀银,则金属银应为极(填“G”或“H”)。
-
(4) 若丙装置用于粗铜精炼,反应一段时间后装置中硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”)。
-
(5) Ⅱ.新冠疫情期间,某同学为解决环境卫生消毒问题,设计了一个电解装置,用于制备“84”消毒液的有效成分,
如图所示,则c为电源的极;该发生器中发生反应的离子方程式为。

-
(6) 若电解过程中转移了
 电子,则膜两侧电解液的质量变化差
电子,则膜两侧电解液的质量变化差 为g。
为g。
下列离子方程式书写正确的是( )
A . 钠与水反应: B . 二氧化锰和浓盐酸反应:
B . 二氧化锰和浓盐酸反应: C . 碳酸氢铵溶液与足量氢氧化钡溶液反应:
C . 碳酸氢铵溶液与足量氢氧化钡溶液反应: D . 足量二氧化硫通入氢氧化钠溶液中:
D . 足量二氧化硫通入氢氧化钠溶液中:
 B . 二氧化锰和浓盐酸反应:
B . 二氧化锰和浓盐酸反应: C . 碳酸氢铵溶液与足量氢氧化钡溶液反应:
C . 碳酸氢铵溶液与足量氢氧化钡溶液反应: D . 足量二氧化硫通入氢氧化钠溶液中:
D . 足量二氧化硫通入氢氧化钠溶液中:
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2 , 下列说法正确的是( )
A . 氧气是氧化产物
B . O2F2既是氧化剂又是还原剂
C . 若生成4.48 L HF,则转移0.8 mol电子
D . 还原剂与氧化剂的物质的量之比为1:4
二氧化氯( )是一种高效的饮用水消毒剂。
)是一种高效的饮用水消毒剂。
 )是一种高效的饮用水消毒剂。
)是一种高效的饮用水消毒剂。
-
(1) 在酸性条件下,
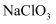 可与
可与 反应生成
反应生成 。写出发生反应的离子方程式:。
。写出发生反应的离子方程式:。
-
(2) 某
 泡腾片的有效成分为
泡腾片的有效成分为 、
、 、
、 , 其溶于水时反应可得到
, 其溶于水时反应可得到 溶液,并逸出大量气体。
溶液,并逸出大量气体。 和
和 反应生成
反应生成 和
和 , 每生成1mol
, 每生成1mol 消耗
消耗 的物质的量为mol,逸出气体的主要成分是(填化学式)
的物质的量为mol,逸出气体的主要成分是(填化学式)
-
(3)
 消毒时会产生少量的
消毒时会产生少量的 , 可利用
, 可利用 将
将 转化为
转化为 除去。控制其他条件相同,
除去。控制其他条件相同, 去除率随温度变化如图所示。温度高于50℃时,ClO
去除率随温度变化如图所示。温度高于50℃时,ClO 去除率随温度升高而降低的原因可能是
去除率随温度升高而降低的原因可能是
-
(4) 为测定某二氧化氯溶液中
 的浓度,进行如下实验:准确量取5.00mL
的浓度,进行如下实验:准确量取5.00mL 溶液,酸化后加入过量的KI溶液,充分反应,加入几滴淀粉溶液,用
溶液,酸化后加入过量的KI溶液,充分反应,加入几滴淀粉溶液,用 溶液滴定至终点。重复上述操作2~3次,平均消耗
溶液滴定至终点。重复上述操作2~3次,平均消耗 溶液27.50mL。已知:
溶液27.50mL。已知: ,
, 
①滴定终点的现象为。
②计算该二氧化氯溶液中
 的物质的量浓度(写出计算过程)。
的物质的量浓度(写出计算过程)。
“中国芯”的发展离不开高纯单晶硅。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应用流程图表示如下:

下列说法错误的是( )
A . 反应①中氧化剂和还原剂的物质的量之比为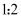 B . 流程中HCl和H2可以循环利用
C . 反应①②③均为置换反应
D . 由反应②③的反应温度推测,③为放热反应
B . 流程中HCl和H2可以循环利用
C . 反应①②③均为置换反应
D . 由反应②③的反应温度推测,③为放热反应
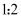 B . 流程中HCl和H2可以循环利用
C . 反应①②③均为置换反应
D . 由反应②③的反应温度推测,③为放热反应
B . 流程中HCl和H2可以循环利用
C . 反应①②③均为置换反应
D . 由反应②③的反应温度推测,③为放热反应
对于下列实验,能正确描述其反应的离子方程式是( )
A . 向饱和石灰水中通入过量 :
: B . 向
B . 向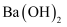 溶液中滴加少量稀硫酸:
溶液中滴加少量稀硫酸: C . 向
C . 向 溶液中滴加稀氨水:
溶液中滴加稀氨水: D . 向
D . 向 溶液中滴加NaOH溶液,颜色由橙色变成黄色:
溶液中滴加NaOH溶液,颜色由橙色变成黄色: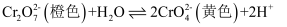
 :
: B . 向
B . 向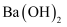 溶液中滴加少量稀硫酸:
溶液中滴加少量稀硫酸: C . 向
C . 向 溶液中滴加稀氨水:
溶液中滴加稀氨水: D . 向
D . 向 溶液中滴加NaOH溶液,颜色由橙色变成黄色:
溶液中滴加NaOH溶液,颜色由橙色变成黄色: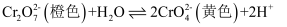
氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。根据所学知识回答下列问题:
-
(1)
 是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验
是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验 是否泄漏,有关反应的化学方程式为
是否泄漏,有关反应的化学方程式为 , 该反应中氧化剂为(填化学式),标准状况下,每生成
, 该反应中氧化剂为(填化学式),标准状况下,每生成 , 反应中转移的电子的物质的量为
, 反应中转移的电子的物质的量为 。
。
-
(2) 在一定条件下,
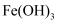 可与
可与 发生反应:
发生反应: , 在此过程中
, 在此过程中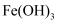 被(填“氧化”或“还原”),
被(填“氧化”或“还原”), 中
中 的化合价是价。
的化合价是价。
-
(3) 某一反应体系有反应物和生成物共七种物质:
 、
、 、
、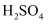 、
、 、
、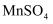 、
、 、
、 , 已知该反应中有气体生成。
, 已知该反应中有气体生成。①该反应中的还原剂是(填化学式,下同),被还原的物质为。
②写出该反应的化学方程式:。
最近更新



