第一章 物质及其变化 知识点题库
-
(1) 方案1:通过置换反应比较:向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是,说明氧化性Ag+>Cu2+。
-
(2) 方案2:通过Cu2+、Ag+分别与同一物质反应进行比较
实验
试剂
编号及现象
试管
滴管

1.0mol·L-1 KI溶液
1.0mol·L-1AgNO3溶液
Ⅰ.产生黄色沉淀,溶液无色
1.0mol·L-1 CuSO4溶液
Ⅱ.产生白色沉淀A,溶液变黄
①经检验, Ⅰ中溶液不含I2 , 黄色沉淀是。
②经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是Cul,确认A的实验如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有 (填离子符号)。
b.白色沉淀B是 。
c.白色沉淀A与AgNO3溶液反应的离子方程式是。说明氧化性Ag+>Cu2+。
-
(3) 分析方案2中Ag+未能氧化I- , 但Cu2+氧化了的原因,设计实验如下:
编号
实验1
实验2
实验3
实验



现象
无明显变化
a中溶液较快变棕黄色,b中电上折出银;电流计指针偏转
C中溶液较慢变浅黄色;电流计指针偏转
(电极均为石墨,溶液浓度均为1mol/L,b、d中溶液pH≈4)
①a中溶液呈棕黄色的原因是 (用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是 。
③方案2中,Cu2+能氧化I- , 而Ag+未能氧化I-的原因。
(资料:Ag++I-=AgI↓ K1=1.2×1016;2Ag++2I-=2Ag↓+I2 K2=8.7×108)
 、
、  、
、  、
、  B . 某强酸性的溶液中:
B . 某强酸性的溶液中:  、
、  、
、  、
、  C . 某强碱性溶液中:
C . 某强碱性溶液中:  、
、  、
、  、
、  D . 某无色碱性溶液中:
D . 某无色碱性溶液中:  、
、  、
、  、
、 
 B .
B .  C .
C .  D .
D . 

根据下列反应回答问题:
A.Ag2O+H2O2=2Ag+O2↑+H2O
B.2H2O2=2H2O+O2↑
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
-
(1) 上述反应中,H2O2分别表现性质。
-
(2) 上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序。
-
(3) 某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式为。
 、
、  、
、  B . 0.1mol·L-1KI溶液:Na+、K+、ClO-、OH-
C . 0.1mol·L-1HCl溶液:Ba2+、K+、CH3COO-、
B . 0.1mol·L-1KI溶液:Na+、K+、ClO-、OH-
C . 0.1mol·L-1HCl溶液:Ba2+、K+、CH3COO-、  D . 0.1mol·L-1NaOH溶液:Mg2+、Na+、
D . 0.1mol·L-1NaOH溶液:Mg2+、Na+、  、
、 
 D . KClO3的电离方程式:KClO3=K++Cl-+3O2-
D . KClO3的电离方程式:KClO3=K++Cl-+3O2-
 +3H2↑
C . 室温下,测得小苏打溶液pH>7,证明碳酸是弱酸:HCO
+3H2↑
C . 室温下,测得小苏打溶液pH>7,证明碳酸是弱酸:HCO  +H2O
+H2O  H2CO3+OH-
D . 将0.10 mol·L-1 NH4Fe(SO4)2溶液与0.40 mol·L-1 NaOH溶液等体积混合:
H2CO3+OH-
D . 将0.10 mol·L-1 NH4Fe(SO4)2溶液与0.40 mol·L-1 NaOH溶液等体积混合:  +Fe3++4OH-=Fe(OH)3↓+NH3·H2O
+Fe3++4OH-=Fe(OH)3↓+NH3·H2O
 CaCl2+2NH3↑+2H2O)
CaCl2+2NH3↑+2H2O) 
-
(1) A发生装置N元素的化合价是,该反应是否是氧化还原反应填(“是”或“否”)。甲、乙、丙三位同学分别用如图所示三套实验装置及化学药品来制取氨气

其中有一位同学没有完成制取并探究氨气性质实验(如果他们的实验操作都正确),你认为没有收集到氨气的同学是填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是(用化学方程式表示)。若用如图装置代替上述A装置来完成实验,装置中加入试剂合理的是。

a.浓氨水
b.浓氨水与CaO
c.NH4Cl与Ca(OH)2
-
(2) 用5.35 g NH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为L。(NH4Cl的摩尔质量为53.5 g/mol)
-
(3) 气体通过C、D装置时,试纸颜色会发生变化的是D,原因是。
-
(4) 当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是。
-
(5) 若收集一集气瓶氨气,检验氨气是否收集满的方法是。
-
(6) 某同学用如图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有性质填序号。

a.还原性
b.极易溶于水
c.与水反应生成碱性物质
-
(7) 氨气的用途很广。如可用氨气处理二氧化氮:8NH3+6NO2=7N2+12H2O,该反应中氨气体现(填“氧化性”或“还原性”)。
 ,沸点为
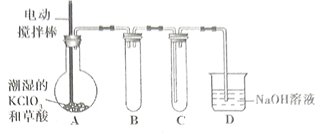
,沸点为  ,易溶于水但不与水反应,在生产和使用时必须用空气、二氧化碳、氮气等“惰性”气体进行稀释,但温度过高、气相浓度过大时均易发生爆炸。工业上用稍潮湿的
,易溶于水但不与水反应,在生产和使用时必须用空气、二氧化碳、氮气等“惰性”气体进行稀释,但温度过高、气相浓度过大时均易发生爆炸。工业上用稍潮湿的 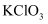 和草酸在
和草酸在  时反应制得(如下图所示),在
时反应制得(如下图所示),在  装置内用冷水吸收
装置内用冷水吸收  。
。 
-
(1) 装置A中发生反应:
 (未配平),当生成
(未配平),当生成  时,同时产生标准状况下
时,同时产生标准状况下  的体积是
的体积是  。
。
-
(2) 实验时,对A装置进行加热操作还需要的玻璃仪器有酒精灯、、。
-
(3) 本实验哪些设计从实验安全角度考虑。(填2条)
-
(4) 装置D中,
 与
与  溶液反应可生成两种盐,且二者物质的量之比为
溶液反应可生成两种盐,且二者物质的量之比为  ,其中一种是
,其中一种是 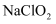 。
。 ①写出
 与
与  溶液反应的离子方程式。
溶液反应的离子方程式。②已知饱和
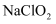 溶液随温度变化情况如下图:
溶液随温度变化情况如下图:
从
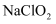 溶液中获得
溶液中获得 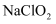 晶体的操作步骤为:减压蒸发结晶→→→
晶体的操作步骤为:减压蒸发结晶→→→  干燥,得到成品。(选择合适的操作编号填空)
干燥,得到成品。(选择合适的操作编号填空)A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤 D.冰水洗涤 E.
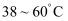 的温水洗涤采用减压蒸发的原因是。
的温水洗涤采用减压蒸发的原因是。 -
(5) 如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,
 、
、  、
、  三种消毒杀菌剂的消毒效率由小到大的顺序是(填化学式)。
三种消毒杀菌剂的消毒效率由小到大的顺序是(填化学式)。
 +H+=CO2↑+H2O
C . 向溴化亚铁溶液中通入足量氯气:2Br-+Cl2=Br2+2Cl-
D . 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
+H+=CO2↑+H2O
C . 向溴化亚铁溶液中通入足量氯气:2Br-+Cl2=Br2+2Cl-
D . 向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O

 HA+OH-
HA+OH-
-
(1) 已知下列反应:①SO3+ H2O=H2SO4
②Br2 +H2O=HBr+HBrO
③2H2O=2H2↑+O2↑
④3Fe+4H2O(g)=Fe3O4+4H2 .
⑤Na2O+2HCl=2NaCl+H2O
反应①的基本反应类型为:,属于置换反应的有(填序号,下同),上述反应中不属于氧化还原反应的有;H2O被氧化的是,H2O被还原的是;属于氧化还原反应,但其中的H2O既不被氧化又不被还原的是。
-
(2) 将下列五种物质:KMnO4、MnSO4、FeSO4、Fe2(SO4)3、K2SO4分别填入下列对应的横线上,组成一个未配平的化学方程式:
++H2SO4→+ ++H2O;
该反应中的氧化产物是(填化学式),被还原的是(填化学式)中的(填元素符号)元素。
-
(3) 用双线桥法表示反应2CuO+C
 2Cu+CO2↑的电子转移方向与数目。
2Cu+CO2↑的电子转移方向与数目。
 +H2O
B . 氨水滴加到AlCl3溶液中:Al3++3OH-=Al(OH)3↓
C . 铜与稀硝酸反应:3Cu+8H++2NO
+H2O
B . 氨水滴加到AlCl3溶液中:Al3++3OH-=Al(OH)3↓
C . 铜与稀硝酸反应:3Cu+8H++2NO =3Cu2++2NO↑+4H2O
D . 氨水中通入少量的SO2气体:SO2+NH3·H2O=HSO
=3Cu2++2NO↑+4H2O
D . 氨水中通入少量的SO2气体:SO2+NH3·H2O=HSO +NH
+NH
 将减小
C . 中和等pH的盐酸和醋酸时,醋酸消耗NaOH的物质的量更多
D . pH=7的某溶液,溶质对水的电离平衡肯定无影响
将减小
C . 中和等pH的盐酸和醋酸时,醋酸消耗NaOH的物质的量更多
D . pH=7的某溶液,溶质对水的电离平衡肯定无影响



