第二节 离子反应 知识点题库
-
(1) 可以导电的有
-
(2) 属于非电解质的有
-
(3) 请写出⑨在水溶液中的电离方程式
-
(4) 写出③中的物质的溶液与⑤的溶液反应的化学方程式
-
(5) 写出①与⑧物质的溶液反应的离子方程式.
-
(1) I、按要求书写下列反应的化学方程式或离子方程式:
实验室制备氨气化学方程式;
-
(2) 工业制备漂白粉化学方程式;
-
(3) 二氧化硫与氧气反应化学方程式;
-
(4) 铝与氢氧化钠溶液反应的离子方程式;
-
(5) 磁性氧化铁与稀硝酸反应离子方程式。
-
(6) II.A~G 的转化关系如下图所示(部分反应物、产物和反应条件未标出)。
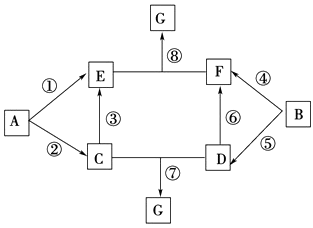
已知:①A、B 为中学化学常见的金属单质,C~G 均为化合物,并且E 和G均含有3 种元素; ②C 是淡黄色固体,D 既能与强酸溶液反应,又能与强碱溶液反应;③F 溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀; ④E 和G 焰色反应均呈黄色。
写出下列物质D 的化学式;
-
(7) ①~⑥反应中,不属于氧化还原反应的是;
-
(8) 将过量的E溶液逐滴加入F 溶液中,出现的现象是;
-
(9) F 和G 溶液混合可以生成白色胶状沉沉,反应的离子方程式为;
-
(10) 反应③中,若有31.2gC 参加反应,转移电子的物质的量为mol。

-
(1) 通入一定量的 CO2 充分反应后的溶液中溶质为(写化学式)
-
(2) AB 段所发生的离子方程式:。
-
(3) 滴加稀盐酸的物质的量浓度为mol/L。
-
(4) 通入二氧化碳的体积为L(在标准状况下)。

-
(1) 图中盛放NaOH溶液的玻璃仪器名称是。
-
(2) 实验前,应先检查装置的;实验开始后,A装置中试管内发生反应的化学方程式为。实验中产生尾气可通入(填写化学试剂)进行吸收处理。
-
(3) B试管中装有5mL1mol•L-1FeCl3溶液,往其中通入足量的SO2 气体,B试管中的实验现象为,写出该反应的离子方程式。
-
(1) 写出下列物质的化学式:A、B、C、D、E。
-
(2) 按要求完成方程式:
①E加热生成D和F的化学方程式
②C溶液和CO2反应生成D的离子方程式
③B与水反应的离子方程式为
 、SO
、SO 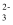 B . 某无色透明溶液中:Fe3+、NH
B . 某无色透明溶液中:Fe3+、NH  、NO
、NO  、SCN-
C . 能使酚酞变红的溶液中:Na+、Cl-、CO
、SCN-
C . 能使酚酞变红的溶液中:Na+、Cl-、CO 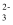 、NO
、NO  D . c(OH-)=0.1 mol·L-1溶液中:HCO
D . c(OH-)=0.1 mol·L-1溶液中:HCO  、K+、Na+、S2-
、K+、Na+、S2-
 B .
B .  C .
C .  D .
D . 
 、
、  和
和  是磷的三种含氧酸,请回答下列问题:
是磷的三种含氧酸,请回答下列问题:
-
(1) 次磷酸不能与高铁酸钾混合使用,原因是二者会发生如下反应,请配平该反应。

-
(2) 某含磷废水的主要成分为
 和
和  ,向废水中加入适量漂白粉,再加入生石灰调节
,向废水中加入适量漂白粉,再加入生石灰调节  ,将磷元素转化为磷酸钙沉淀回收。加入漂白粉的作用是;若测得处理后的废水中
,将磷元素转化为磷酸钙沉淀回收。加入漂白粉的作用是;若测得处理后的废水中  ,
,  的含量为
的含量为  ,则
,则  。
。
-
(3) 25℃时,向一定体积的亚磷酸(
 ,二元弱酸)溶液中滴加等物质的量浓度的
,二元弱酸)溶液中滴加等物质的量浓度的  溶液,混合液中含磷粒子的物质的量分数(δ)与溶液
溶液,混合液中含磷粒子的物质的量分数(δ)与溶液  的关系如图所示。
的关系如图所示。 
①
 为(填“正盐”或“酸式盐”),其溶液显碱性的离子方程式为。
为(填“正盐”或“酸式盐”),其溶液显碱性的离子方程式为。②
 点时,溶液中水电离出的
点时,溶液中水电离出的  。
。③所加
 溶液体积与亚磷酸溶液相同时,溶液中各离子的物质的量浓度由大到小的顺序为。
溶液体积与亚磷酸溶液相同时,溶液中各离子的物质的量浓度由大到小的顺序为。④将浓度均为
 的
的  和
和  的混合液加水稀释10倍后,溶液中
的混合液加水稀释10倍后,溶液中  将(填“增大”、“减小”或“不变”)。
将(填“增大”、“减小”或“不变”)。
 溶液中逐滴加入
溶液中逐滴加入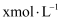 的氨水,导电能力、pH与
的氨水,导电能力、pH与 的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( )
的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( )
 B .
B .  , 该温度下的
, 该温度下的 C . 该温度下反应
C . 该温度下反应 的平衡常数的数量级为
的平衡常数的数量级为 D . a点对应的溶液中存在
D . a点对应的溶液中存在
-
(1) I.甲、乙两同学根据实验室提供的下列试剂,设计了两个原理不同的简单实验,请补充完整相应的实验方案,证明镁元素的金属性比铝元素强。
试剂:镁条(已除去表面的氧化膜)、铝条(已除去表面的氧化膜)、氯化铝溶液、氯化镁溶液、稀盐酸、氢氧化钠溶液。
方案一:甲同学选用镁条、铝条和盐酸溶液,选择依据是;甲同学设计的方案是。
方案二:乙同学选用氯化镁溶液、氯化铝溶液、氢氧化钠溶液,选择依据是;乙同学设计的方案是。
-
(2) 铁投入
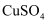 溶液中,能置换出铜;钠投入
溶液中,能置换出铜;钠投入 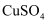 溶液中,不能置换出铜,以此判断出钠比铁的金属性弱,这种说法是否合理?,理由是。
溶液中,不能置换出铜,以此判断出钠比铁的金属性弱,这种说法是否合理?,理由是。
-
(3) II.另一活动小组为了验证元素非金属性的递变规律,设计了如图所示的实验装置进行实验探究:

B装置中的X溶液是;其作用为。
-
(4) 能说明碳元素和硅元素非金属性强弱的实验现象是;C中反应的离子方程式为。
-
(5) 若没有装置B,则会产生的影响是。
-
(6) 若将分液漏斗中的硝酸改为盐酸,(填“能”或“不能”)证明非金属性
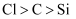 ,若能,请说明理由,若不能,请提出改进方案:。
,若能,请说明理由,若不能,请提出改进方案:。
①2S(s) + Cl2(g)  S2Cl2(l);
S2Cl2(l);
②S2Cl2(l)+ Cl2(g) = 2SCl2(l)。
已知相关物质的性质如下表所示:
物质 | 外观 | 熔点/℃ | 沸点/℃ | 水溶性 |
S | 淡黄色粉末 | 118 | 445 | 不溶 |
S2Cl2 | 黄红色液体 | -80 | 138 (分解) | 剧烈反应 |
SCl2 | 红棕色液体 | -78 | 60 | 剧烈反应 |
某小组在实验室模拟工业制备二氯化硫时设计了如下实验装置(部分夹持装置已略去) 。

回答下列问题:
-
(1) 装置A中发生反应的离子方程式为。
-
(2) C装置中盛放的试剂为 ,D装置中X仪器的名称是。
-
(3) 第①步反应需要控制温度在100~110℃,温度不宜过高的原因是,判断第①步反应已经进行完全的实验现象是。
-
(4) 第②步反应后得到SCl2粗品,从混合物中分离出产品的操作方法是。
-
(5) 装置E的作用是。
-
(6) 向水中加入几滴制备的SCl2 , 可观察到淡黄色浑浊,并有刺激性气味的无色气体逸出,根据实验现象,写出SCl2与水反应的化学方程式。

回答下列问题:
-
(1) 分液漏斗使用前必须进行的操作为,欲使分液漏斗内的浓盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或。
-
(2) 装置的正确连接顺序是(按气流方向,用小写字母表示)。
-
(3) 装置C中发生Cl2O的制备反应中的固体产物为NaHCO3和NaCl,写出该反应的化学方程式。反应一段时间后,装置B中观察到的实验现象为。
-
(4) 研究表明,装置B中Cl2O的收率与装置C的温度和纯碱的含水量的关系如下表所示:
温度/℃
纯碱中含水量/%
Cl2O的收率/%
0~10
5.44
67.85
0~10
7.88
89.26
10~20
8.00
64.24
30~40
10.25
52.63
30~40
12.50
30.38
本实验中适宜选用的温度范围和纯碱的含水量分别为、。
-
(5) 装置F中盛放碱石灰的仪器名称为,碱石灰的作用为。
-
(6) 若将少量Cl2O气体通入用稀硫酸酸化的KI-淀粉溶液中,溶液会变蓝色,溶液变蓝色的原因为(用离子方程式表示)。



