离子方程式的有关计算 知识点题库
在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是( )
A . 原溶液中c(H2SO4) = a/2 mol/L
B . 沉淀的物质的量a/2 mol
C . 溶液中2c(Na+)=c(SO42-)
D . 0<沉淀的物质的量<a/2 mol
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+ , 当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是 ,它们的物质的量浓度之比为 ,所加淡黄色固体是 (填化学式).

有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH﹣):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3﹣、CO32﹣ , 现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )

A . 原溶液一定不存在H+、Cu2+、CO  B . 不能确定原溶液是否含有K+、NO
B . 不能确定原溶液是否含有K+、NO  C . 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D . 实验所加的NaOH溶液浓度为2mol/L
C . 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D . 实验所加的NaOH溶液浓度为2mol/L
 B . 不能确定原溶液是否含有K+、NO
B . 不能确定原溶液是否含有K+、NO  C . 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D . 实验所加的NaOH溶液浓度为2mol/L
C . 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D . 实验所加的NaOH溶液浓度为2mol/L
把200mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含b mol硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A . 0.1(b﹣2a) mol•L﹣1
B . 10(2a﹣b) mol•L﹣1
C . 10(b﹣a) mol•L﹣1
D . 10(b﹣2a) mol•L﹣1
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )

A . 混合酸中H2SO4浓度为4 mol•L﹣1
B . 200mL混合酸中NO3﹣物质的量为0.2mol
C . AB段的反应为Fe+2Fe3+═3Fe2+ , BC段产生氢气
D . 加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4
向含SO32﹣、Fe2+、Br﹣、I﹣各0.1mol的溶液中通入标准状况下的Cl2 , 通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )
阴离子 | CO32﹣、SiO32﹣、[Al(OH)4]﹣、Cl﹣ |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
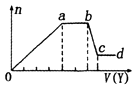
A . 若Y是盐酸,则X中一定含有CO32﹣、SiO32﹣、[Al(OH)4]﹣和NH4+
B . 若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl﹣
C . 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH﹣═NH3↑+H2O
D . 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4
分别用20mL 1mol/L BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
A . 3:2:2
B . 1:2:3
C . 1:3:3
D . 3:1:1
已知:2Fe2++Br2=2Fe3++2Br- , 2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2 , 溶液中某些离子的物质的量变化如下图所示。下列说法中,错误的是()

A . 还原性:I->Fe2+>Br-
B . 原混合溶液中FeBr2的物质的量为6mol
C . 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D . 当通入2mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1L,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
-
(1) 根据上述3组实验可以分析废水中一定不存在的阴离子是,一定存在的阳离子是。
-
(2) 写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:。
-
(3) 分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为,所得沉淀的最大质量是g。
-
(4) 若通过实验确定原废水中c(Na+)=0.18 mol·L-1,试判断原废水中NO3-是否存在?(填“存在”“不存在”或“不确定”)。若存在, c(NO3-) = mol·L-1。(若不存在或不确定则此空不填)
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3 , 且产物的成分与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
A . 某温度下,反应后c(Cl﹣):c(ClO﹣)=6,则溶液中c(ClO﹣):c(ClO3﹣)=1
B . 参加反应的氯气的物质的量等于0.5amol
C . 改变温度,反应中转移电子的物质的量n的范围: a/2mol<n<5a/6mol
D . 改变温度,产物中KClO3的最大理论产量为a/6mol
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为:( )
A . 0.25 mol
B . 0.5 mol
C . 1 mol
D . 2 mol
现有铁粉和Br2物质的量都为n mol充分反应,加水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是( )
A . 当a = 1/3n时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B . 当a = 3/2n时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C . 若溶液中Br-有一半被氧化时,溶液中c(Fe3+): c(Br-):c(Cl-) =1:1:3
D . 当0<a<1/2n时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c (Cl-)+c(Br-)+ c(OH-)
室温时,盐酸和硫酸的混合溶液20 mL,向混合物中逐滴加入0.05 mol/L Ba(OH)2溶液,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法错误的是( )

A . 原混合液中盐酸物质的量浓度为0.2 mol/L
B . 逐滴加入Ba(OH)2溶液,当体积为40 mL,此时发生的离子方程式:OH-+H+=H2O
C . 生成沉淀的最大质量m=2.33g
D . 现将上述20 mL酸混合溶液与60 mL Ba(OH)2溶液直接混合,发生的离子方程式:Ba2++6OH-+SO42-+6H+=BaSO4↓+6H2O
把500mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该溶液中钾离子浓度为:( )
A . 0.1(b-2a)mol/L
B . 10(b-2a)mol/L
C . 10(2a-b)mol/L
D . 4(b-2a)mol/L
1L稀硝酸和稀硫酸的混合溶液中,硝酸和硫酸的物质的量浓度均为  。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
 。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
V2O5(五氧化二钒)可作化学工业中的催化剂,广泛用于冶金、化工等行业。工业上利用冶炼铝生成的固体废料一一赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取V2O5其工艺流程图如图:

已知:①NH4VO3是白色粉末,微溶于冷水,可溶于热水。
②NH4VO3  V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
③V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。
④部分稀土金属氯化物在乙醇中溶解度较小。
-
(1) “碱浸”时对赤泥进行粉碎的目的是。写出滤液1中通入足量CO2时所发生主要反应的离子方程式:。
-
(2) 将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,写出该磁性产品与稀硝酸反应的离子方程式:。
-
(3) “洗涤”操作时可选用的洗涤剂有___。(填字母)A . 冷水 B . 热水 C . 1%NH4Cl溶液 D . 乙醇
-
(4) 需在流动空气中灼烧的原因可能是。
-
(5) 将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol•L-1Na2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为。
(已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字)
-
(6) 水系锌离子电池是一种新型二次电池,以Zn(CF3SO3)2(三氟甲磺酸锌)为电解质,工作原理如图。放电时V2O5电极上的电极反应式为。

已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3 , 且  的值与温度高低有关,当n(NaOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关,当n(NaOH)=amol时,下列有关说法错误的是( )
 的值与温度高低有关,当n(NaOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关,当n(NaOH)=amol时,下列有关说法错误的是( )
A . 参加反应的氯气的物质的量为 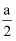 mol
B . 改变温度,产物中NaClO3的最大理论产量为
mol
B . 改变温度,产物中NaClO3的最大理论产量为  mol
C . 改变温度,反应中转移电子的物质的量n(e-)的范围:
mol
C . 改变温度,反应中转移电子的物质的量n(e-)的范围: 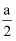 mol≤n(e-)≤
mol≤n(e-)≤  mol
D . 某温度下,若反应后
mol
D . 某温度下,若反应后  =11,则溶液中
=11,则溶液中  =
= 
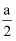 mol
B . 改变温度,产物中NaClO3的最大理论产量为
mol
B . 改变温度,产物中NaClO3的最大理论产量为  mol
C . 改变温度,反应中转移电子的物质的量n(e-)的范围:
mol
C . 改变温度,反应中转移电子的物质的量n(e-)的范围: 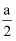 mol≤n(e-)≤
mol≤n(e-)≤  mol
D . 某温度下,若反应后
mol
D . 某温度下,若反应后  =11,则溶液中
=11,则溶液中  =
= 
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A . 60 mL
B . 90 mL
C . 120 mL
D . 150 mL
实验室模拟工业以NH3和CS2为原料制备KSCN的实验装置如图所示:
已知:①NH3不溶于CS2 , CS2密度比水大且难溶于水;②三颈烧瓶内盛放CS2、水和催化剂,发生反应:CS2+3NH3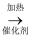 NH4SCN+NH4HS,该反应比较缓慢,且NH4SCN高于170℃易分解。③KSCN的溶解度随温度变化较大。
NH4SCN+NH4HS,该反应比较缓慢,且NH4SCN高于170℃易分解。③KSCN的溶解度随温度变化较大。

-
(1) 装置A中的烧瓶内固体可选用(填字母),装置B可以选用(填字母)。
A.碳酸氢铵 B.生石灰 C.碱石灰 D.二氧化锰 E.氯化钙
-
(2) 三颈烧瓶内的导气管插入下层CS2液体中,原因是。
-
(3) 待实验中观察到三颈烧瓶内液体不分层时,关闭A处分液漏斗活塞,待D中无气泡产生时关闭K1保持三颈烧瓶内恒温105℃一段时间,使NH4HS=NH3↑+H2S↑进行完全后,打开K2 , 继续保持恒温105℃,滴入适量的KOH溶液,写出生成KSCN的化学方程式。
-
(4) 装置E的作用,写出E中生成浅黄色沉淀的离子方程式。
-
(5) 反应结束后将三颈烧瓶中的固体催化剂滤去,得到硫氰化钾粗品,经过(填操作名称)可将硫氰化钾晶体纯化。
-
(6) 晶体中KSCN含量的测定:称取10.00g样品,配成1000mL溶液。量取25.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000mol•L-1AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液数据如下。(已知:滴定时发生的反应为SCN-+Ag+=AgSCN↓(白色))
序号
1
2
3
4
标准溶液体积/mL
20.05
18.40
19.95
20.00
①指示剂a为。
②晶体中KSCN的质量分数为%。
最近更新



