离子方程式的有关计算 知识点题库
完成下列填空:
-
(1) 碳元素有12C、13C和14C等同位素.在14C原子中,核外存在 对自旋相反的电子.
-
(2) 碳在形成化合物时,其所成化学键以共价键为主,原因是
-
(3) 任选上述元素可组成多种四原子的共价化合物,请写出其中含非极性键的一种化合物的电子式
-
(4) 上述元素可组成盐NH4Al(SO4)2 . 向10mL1mol/L NH4Al(SO4)2溶液中滴加1mol/L的NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下.
①NH4Al(SO4)2溶液中所有离子的浓度由大到小的顺序是 ,请解释阳离子浓度差异的原因 .
②写出N点反应的离子方程式 .
③若向10mL1mol/L NH4Al(SO4)2溶液中加入20mL1.2mol/LBa(OH)2溶液,充分反应后,产生沉淀 mol.

(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为 .
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4↑+10CO↑
上述反应中的各种物质,属于酸性氧化物的有 .
(3)白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒.白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:
①P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4
②P4+CuSO4+H2O→Cu+H3PO4+H2SO4
反应①中,氧化剂为 ,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为 .
(Ⅱ)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象: ,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为 .
(Ⅲ)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用.通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b.(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.)
(1)若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为 .
(2)若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有

工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO ﹣、ClO 3﹣的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )



据图回答问题:
-
(1) 比较g、h的最高价氧化物对应的水化物的酸性强弱是:.
-
(2) 上述元素可组成盐R:zx4f(gd4)2 , 向盛有R溶液的烧杯中滴加1mol•L﹣1NaOH溶液,沉淀物质的量随NaOH溶液体积变化如图2:
写出m点反应的离子方程式.
若向该R溶液加20mL1.2mol•L﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol.

-
(1) 写出用惰性电极电解M溶液的离子方程式.
-
(2) 若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是.
-
(3) 若A是一种常见金属单质,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是.
-
(4) 若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式.
-
(5) 若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是.
-
(6) 若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图2所示,由此可知,该溶液中除H+和Al3+外肯定还含有离子.
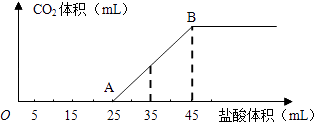
-
(1) 写出OA段所发生反应的离子方程式、
-
(2) 当加入35mL盐酸时,产生CO2的体积为 mL(标准状况).
-
(3) 计算原混合物中NaOH的质量及碳酸钠的质量分数.
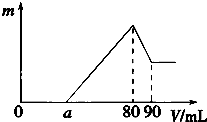
-
(1) )80~90mL对应反应的离子方程式.
-
(2) 金属铝的质量为
-
(3) 盐酸的体积是mL.
-
(4) a的取值范围是.
-
(5) n(Mg)/n(Al)的最大值是.
 C . 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D . 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
C . 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D . 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
 B .
B .  C .
C .  D .
D . 

-
(1) 写出混合物溶于水时发生反应的离子方程式、.
-
(2) 写出AB段反应的离子方程式.B点的沉淀物的化学式为.
-
(3) 原混合物中AlCl3的物质的量是mol,NaOH的质量是g.
-
(4) Q点加入的HCl溶液体积是mL.

①写出m点反应的离子方程式:.
②若10mL1mol•L﹣1 NH4Al(SO4)2溶液中改加20mL1.2mol•L﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol(列式计算)

 mol/L
B .
mol/L
B .  mol/L
C .
mol/L
C .  mol/L
D .
mol/L
D .  mol/L
mol/L
 、
、 、
、 、NH4+、
、NH4+、 、
、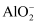 。当向该溶液中逐滴加入
。当向该溶液中逐滴加入 溶液时,产生沉淀的物质的量
溶液时,产生沉淀的物质的量 与加入
与加入 溶液的体积
溶液的体积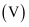 的关系如图所示,下列说法正确的是(已知:NH
的关系如图所示,下列说法正确的是(已知:NH + OH-=NH3·H2O)( )
+ OH-=NH3·H2O)( )
 、
、 、
、 B . 原溶液中可能含有
B . 原溶液中可能含有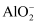 C . 原溶液中
C . 原溶液中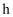 +与
+与 的物质的量之比为
的物质的量之比为 :2
D . 原溶液中
:2
D . 原溶液中 与NH
与NH 的物质的量之比为
的物质的量之比为
 溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图)。对反应后的溶液进行分析,溶液中
溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图)。对反应后的溶液进行分析,溶液中 与
与 之比为2∶3。下列说法不正确的是( )
之比为2∶3。下列说法不正确的是( )

 B . 反应的离子方程式为:
B . 反应的离子方程式为: C . 反应后的溶液中:
C . 反应后的溶液中: D . 反应后的溶液再生为
D . 反应后的溶液再生为 :加入足量铁粉,过滤,滤液中通入足量
:加入足量铁粉,过滤,滤液中通入足量



