离子方程式的有关计算 知识点题库
-
(1) 充分反应后,溶液中存在4.8g不溶物的成分为(用化学式表示).
-
(2) 充分反应后溶液中一定不存在的金属离子为.
-
(3) 比较Fe2+、Fe3+、Cu2+的氧化性大小:.
-
(4) 试计算最后溶液中Fe2+离子的物质的量浓度 mol/L.

物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | ﹣ |
-
(1) Ⅰ.某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?(填“合理”或“不合理”).
-
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是,反应的离子方程式为.
-
(3) 实验室溶解该熔融物,在下列试剂中最适宜的试剂是 (填序号).A . 浓硫酸 B . 稀硫酸 C . 稀硝酸 D . 氢氧化钠溶液
-
(4)
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

图中OC段没有沉淀生成,此阶段发生反应的离子方程式为.
-
(5) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式;
-
(6) A点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL.
 B .
B .  C .
C .  D .
D . 


请回答下列问题:
-
(1) 根据上述3组实验可以分析废水中一定不存在的阴离子是
-
(2) 写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子方程式:。沉淀溶解时发生的离子方程式为
-
(3) 分析图像,在原溶液中c(NH4+与c(Al3+)的比值为,所得沉淀的最大质量是g。
-
(4) 若通过实验确定原废水中c(Na+) =0.18 mol·L-1 , 试判断原废水中NO3-是否存在?(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)= mol·L-1。(若不存在或不确定则此空不填)

-
(1) 某工厂排放出有毒物质NOCl,它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2 , 该反应的离子方程式为
-
(2) 某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,发生反应的化学方程式为:2FeCl3+Cu=2FeCl2+CuCl2。实验小组的同学对生产印刷电路板的废液成分进行了如下探究:
①取少量废液,滴加KSCN溶液显红色。
②取100mL废液,加入足量的AgNO3溶液,析出沉淀43.05g。
③另取100mL废液,加入一定质量的铜片,充分反应后,测得铜片的质量减少了2.56g,再向反应后的溶液中滴加KSCN溶液不变色。
根据探究实验得出结论:
a.废液中含有的金属离子是。
b.100mL废液中Cl-的物质的量是。
c.原100mL废液中铜离子的物质的量浓度是。
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以1计) |
20~50mg/kg |
|
分装时期 |
|
|
分装企业 |
-
(1) 碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KlO3+KI+H2SO4=K2SO4+I2+H2O
-
(2) 上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是。
-
(3) 已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg。
-
(1) 原混合液中H+的物质的量浓度为 mol·L-1。
-
(2) 当加入的Ba(OH)2体积为75 mL时,产生的沉淀质量为 g。


-
(1) 该浓硫酸的物质的量浓度为。
-
(2) 某学生欲用上述浓硫酸和蒸馏水配制480mL0.500mol×L-1稀硫酸。
①配制稀硫酸时,选用仪器有量筒、烧杯、玻璃棒、。
②该学生需要用量筒量取mL,上述浓硫酸进行配制。
-
(3) 在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)。
①用量筒量取浓硫酸时仰视观察凹液面:。
②定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:。.
-
(4) 该同学将所配制的0.500mol×L-1的硫酸溶液逐滴滴加到0.500mol×L-1Ba(OH)2溶液中,产生沉淀的质量与加入硫酸体积关系如图所示:
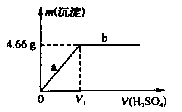
①该反应的离子方程式为。
②充分反应后生成沉淀质量为4. 66 g,则消耗Ba(OH)2溶液的体积为mL。
已知发生的反应为:C6H8O6+I2=C6H6O6+2H++2I- , 2S2O32-+I2=S4O62-+2I-
该溶液中维生素C的物质的量是多少mol?(写出简要的计算过程)。
-
(1) 氧化剂是,氧化产物是。(填化学式)
-
(2) 氧化剂与还原剂的物质的量之比为。
-
(3) 若生成71 g Cl2 , 则消耗的HCl是mol,被氧化的HCl是mol,转移的电子的物质的量是mol。
-
(4) 将此反应改写成离子方程式。



