饱和溶液与不饱和溶液 知识点题库
20℃时,向甲烧杯中加入25g水和25g固体固体A,向乙烧杯中加入25g水和25g固体B(A、B两种物质均不与水反应).充分搅拌后,甲烧杯中固体剩余,乙烧杯中固体全部溶解.请回答下列问题:
-
(1) 20℃时,甲烧杯中溶液(填“一定”或“不一定”,下同) 是饱和溶液;乙烧杯中溶液(填“一定”或“不一定”,下同)是饱和溶液.
-
(2) 20℃时,A的溶解度(填“大于”、“小于”或“等于”)B的溶解度.
-
(3) 20℃时,为判断乙烧杯中溶液是否饱和,除采用实验的方法外,还可以利用题中已有数据和来判断.
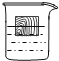
60℃时,某同学在盛有硝酸钾饱和溶液的烧杯中,漂浮一个木块(如图),然后将溶液冷却到室温(20℃).请你说出观察到的两个现象,并运用你学过的化学知识和物理知识分别解释这些现象产生的原因.
化学中有许多概念既是相对的,又是统一的,如图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系.

-
(1) 从图中可以看出,饱和溶液与浓溶液的关系是(填“并列”、“交叉”或“包含”).
-
(2) 已知20℃时,100g水中最多可以溶解36g的氯化钠,则20℃时,0.9%医用生理盐水可归于图中区域(选填“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”).
20℃时,向3个盛有50克水的烧杯中,分别加入一定质量的氯化钠,并充分溶解。根据下表实验数据回答。
实验编号 | A | B | C |
加入氯化钠的质量(克) | 9 | 16 | 27 |
溶液质量(克) | 59 | 66 | 68 |
-
(1) 实验所得3杯溶液中,属于不饱和溶液的是(选填编号)。
-
(2) 若将A杯中的溶液稀释成溶质的质量分数为0.9%的生理盐水,需加水克。
下列有关溶液的说法中,正确的是( )
A . 溶液都是澄清、透明、无色的
B . 溶液都是由一种溶质和一种溶剂混合而成的
C . 饱和溶液中溶质的质量分数一定比不饱和溶液中溶质的质量分数大
D . 向100g硝酸钾的饱和溶液加入10硝酸钾固体,溶质的质量分数不变
20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是( )

A . 所得溶液可能都是饱和溶液
B . 20℃时,乙溶液的溶质质量最小
C . 溶液溶质的质量分数:甲>丙>乙
D . 升高温度,溶液溶质的质量分数一定变大
20℃时,在盛有100g水的甲、乙两个烧杯中,分别加入30克的A、B两种物质,充分搅拌后,现象如图所示,下列说法正确的是( )

A . 烧杯甲中的溶液一定是不饱和溶液
B . 烧杯乙中溶液质量是130克
C . 烧杯甲中溶液降温过程中,溶液溶质质量分数可能不变
D . A物质的溶解度一定大于B物质
在一个大萝卜上挖个坑,向其中注入20℃时的饱和食盐溶液,一段时间后,发现萝卜变软,而坑里液体的体积增加。下列有关这一变化的说法正确的是( )
A . 萝卜变软的原因是细胞吸水
B . 变化后的液体仍是20℃时的饱和食盐溶液
C . 液体体积增加的主要原因是吸收了空气中的水蒸气
D . 20℃时,将少量的食盐加入到变化后的溶液中还能溶解
一定温度下,向图Ⅰ烧杯中加入一定量的水,结果如图Ⅱ所示,所得溶液与原溶液相比,下列判断一定正确的是( )

A . 溶质的质量增加
B . 溶质的溶解度变大
C . 所得溶液是饱和溶液
D . 溶质的质量分数变大
如图甲所示是一种简易的天气预报瓶,瓶内装有一定量的水和硝酸钾晶体,可根据瓶内品体析出量来判断气温的大致变化。如将瓶子放置于20℃的坏境下,出现的现象如图乙所示。随着外界温度的变化,也会出现如图丙丁所示的现象。则下列判断正确的是( )

A . 三种情况下,外界温度最高的是丙图的环境
B . 从图乙到图丙,溶质的质量分数变小
C . 图丙中溶液一定是硝酸钾的不饱和溶液
D . 溶液中溶质质量的大小关系是:丙<乙<丁
下列说法中,正确的是 ( )
A . 从溶液中结晶析出的晶体都含结晶水
B . 饱和溶液冷却析出晶体后的溶液一定是饱和的
C . 结晶水合物中含有水分子,所以它是混合物
D . 若硝酸钾溶液中混有少量的氯化钠,可通过蒸发溶剂的方法分离
20℃时,将等质量的甲、乙两种固体(不含结晶水),分别加入到盛有100g水的烧杯中充分搅拌后,现象如图1;升温到50℃时,现象如图2,请结合图示回答下列问题:

-
(1) 图 1 中,A、B 烧杯内的溶液一定为饱和溶液的是 (选填 A 或 B)。
-
(2) C、D 二个烧杯中的溶液,其溶质质量分数的大小关系是 。
如表是氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度,回答问题。
|
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
||||||
|
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
|
KNO3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110.0 |
-
(1) 两种物质中,溶解度受温度影响变化较大的是。
-
(2) 60 ℃时,按图示操作:

A中溶液是(填“饱和”或“不饱和”)溶液,C中溶液的总质量是克。
-
(3) 50 ℃时,将两种物质的饱和溶液各100克,分别加热蒸发10克水后,再恢复到50 ℃,剩余溶液的质量:NaCl溶液(填“大于”“等于”或“小于”)KNO3溶液。
在“研究物质的溶解性”实验中,小科将2.0g硝酸钾放到少量水中,充分振荡后静置,如图甲。

-
(1) 图甲中的硝酸钾溶液是该温度下的(填“饱和”或“不饱和”)溶液。
-
(2) 对该试管进行加热得到如图乙所示的溶液,此时溶液的溶质质量分数与原溶液相比将(填“变大”、“变小”或“不变”)。
20℃时,向3个盛有50克水的烧杯中,分别加入一定质量的氯化钠,并充分溶解。根据下表实验数据回答。
|
烧杯编号 |
A |
B |
C |
|
加入氯化钠的质量(克) |
9 |
18 |
27 |
|
溶液质量(克) |
59 |
68 |
68 |
-
(1) 实验所得3杯溶液中,属于不饱和溶液的是(填编号)。
-
(2) 利用表中数据,计算C杯中的溶液的溶质质量分数?(计算结果精确到0.1%)
甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是( )

A . ①溶液质量增加,②溶液质量减少
B . ①②两溶液均变为不饱和溶液
C . 甲的溶解度大于乙的溶解度
D . ①溶液中溶质的质量分数大于②溶液
氯化钠俗名食盐,是工业生产和生活的一种重要原料,也是实验室里常见的一种药品。下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题:
|
实验序号 |
水的质量(g) |
加入氯化钠的质量(g) |
溶液的质量(g) |
|
① |
20 |
4 |
24 |
|
② |
20 |
6 |
26 |
|
③ |
20 |
8 |
27.2 |
|
④ |
20 |
10 |
m |
-
(1) 表中m=;
-
(2) 实验②所得溶液的溶质质量分数为(保留0.1%)
-
(3) 在这4次实验中,得到的20℃氯化钠溶液属于饱和溶液的是。(填实验序号)
-
(4) 20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液稀释成5%的氯化钠溶液,需加入水多少克?
水和溶液在生命活动和生产、生活中起着十分重要的作用。

-
(1) 小红同学用图1装置对学校附近某河水的水质进行净化,经过此装置后,所得水为(填“纯净物”或“混合物”)。
溶液的温度/℃
75
65
50
35
20
析出固体质量M 的质量/g
0
0
2.0
4.5
8.4
-
(2) 烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于温室环境中,测定不同温度时析出固体M的质量。测定结果记录如上表:
若不考虑水蒸发对实验的影响,请回答下列问题。
①65℃时,(填“能”或“不能”)判断该溶液是饱和溶液。
②40℃时接近饱和的M溶液变成饱和溶液,下列方法中能达到目的的有。
A. 升温 B.降温 C.加固体M D.恒温蒸发水
-
(3) 如图2实验,将水加入到试管中,观察到a液面下降,b液面上升,饱和石灰水变浑浊,则X固体可能为,由此实验现象得到的结论是 。
在一定温度下,向100g水中依次加入一定质量的氯化钾固体,充分溶解,加入氯化钾的质量与得到相应溶液质量的关系如图所示:

-
(1) 实验③的溶液是否为饱和溶液?(填“是”“不是”或“无法判断”)。
-
(2) 实验①②③的溶液,溶质的质量分数分别为a、b、c,则它们的大小关系是(用“>”“<”或“=”表示出来)。
在 20℃时,刘冰同学向 100g 水中依次加入 NaCl 固体,充分溶解。实验过程如图所示。下列说法错误的是( )

A . 20℃时,NaCl 的溶解度为 36g
B . 图②中的溶液是不饱和溶液
C . 图③中溶液的溶质质量为 40g
D . 图③和图④中 NaCl 溶液的溶质质量分数相等
最近更新



