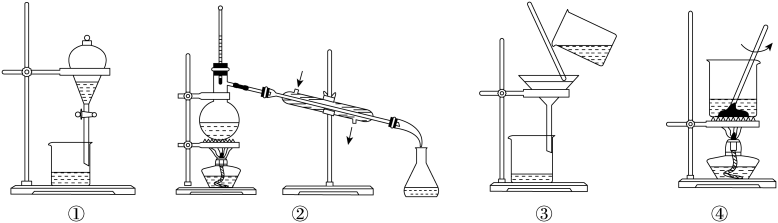
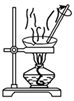
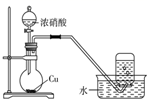
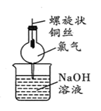
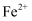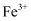蒸发和结晶、重结晶 知识点题库
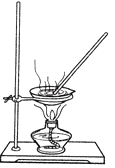
某研究性学习小组的同学设计一套方案,在实验室中制取肥皂(如图为硬脂酸甘油酯在碱性条件下水解的装置图)及甘油.已知酒精的沸点为78.5℃、甘油的沸点为290℃,硬脂酸甘油酯的沸点为260℃.
皂化反应的步骤如下:
①在蒸发皿中加入7~8g硬脂酸甘油酯,然后加入5mL NaOH溶液、10mL酒精.
②在不断搅拌下对蒸发皿中液体进行微热,直到混合物变稠.
③待水解完全后,将盛有混合物的蒸发皿放入冷水浴中进行冷却,稍待片刻后,向混合物中加入20mL热蒸馏水,再放入冷水浴中冷却,然后加入25mL饱和食盐水并充分搅拌.
④用纱布滤出上层固态物质并将其挤干,然后进行成形处理即得到肥皂.
请回答下列问题:
-
(1) 写出皂化反应的化学方程式:
-
(2) 不用大火加热的原因: ,确定油脂完全水解的依据 .加入饱和食盐水的目的是 ,加入饱和食盐水后固态物质在上层,下层物质是
-
(3) 有人认为肥皂水属于胶体,如何确定此判断是否正确?
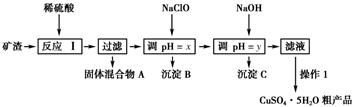
已知:①Cu2O+2H+=Cu+Cu2++H2O。
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
-
(1) 为了加快反应Ⅰ的速率,可以采取的措施是 (任写1条)。
-
(2) 固体混合物A中的成分是。
-
(3) 反应Ⅰ完成后,铁元素的存在形式为(填离子符号);检验该离子常用的方法之一是:取少量含该离子的溶液于试管中,滴加几滴铁氰化钾溶液,会产生沉淀,写出该反应的离子方程式。
-
(4) 操作1主要包括:、、。洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是。
-
(5) 用NaClO调pH可以生成沉淀B,利用题中所给信息分析沉淀B为,该反应中氧化剂与还原剂的物质的量之比为。
-
(6) 用NaOH调pH可以生成沉淀C,利用题中所给信息分析y的范围为。
 B .
B .  C .
C .  D .
D . 
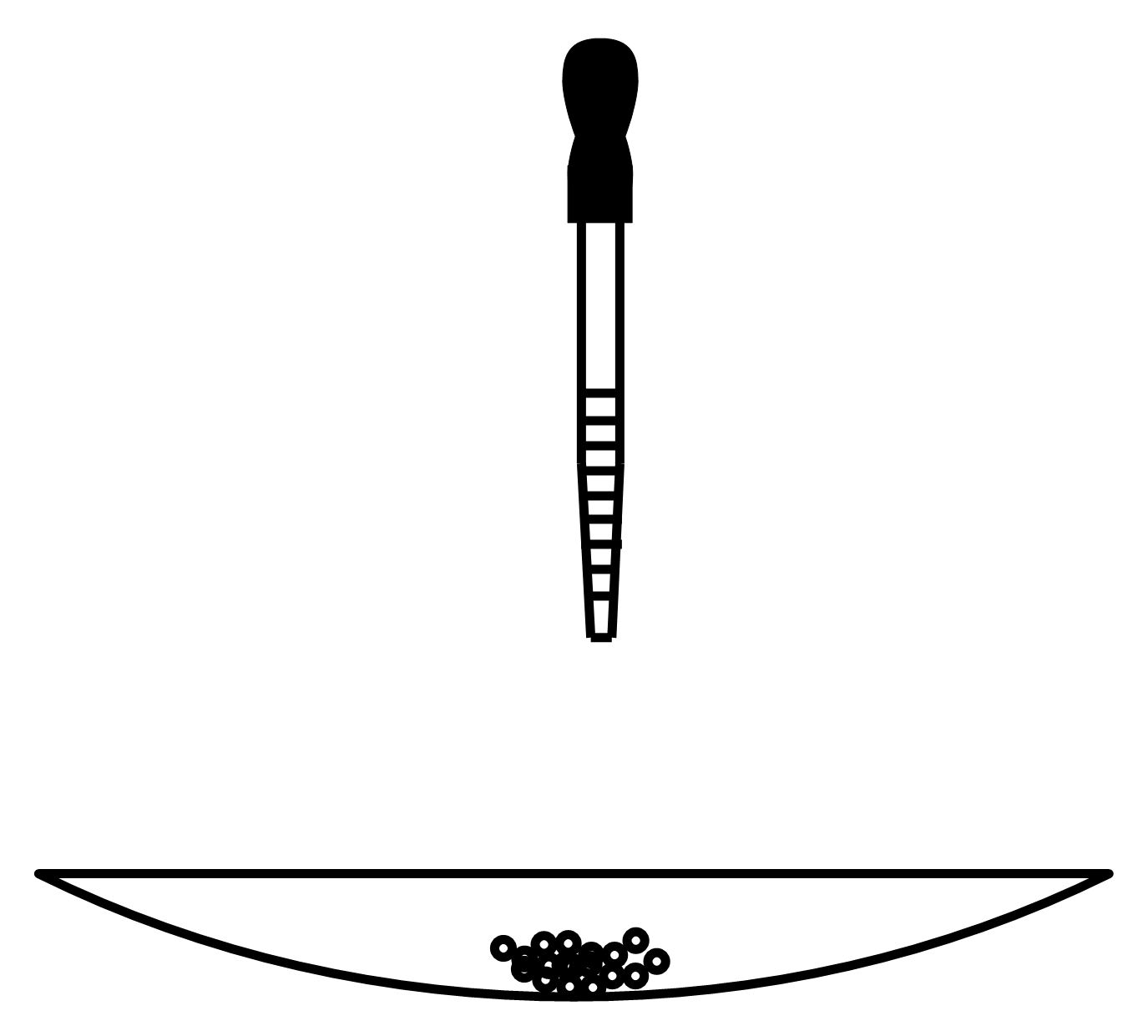
A.将滤液静置,使其缓慢冷却结晶;
B.将1g粗苯甲酸加到100mL的烧杯中,再加入50mL蒸馏水;
C.全部溶解后再加入少量蒸馏水;
D.在石棉网上加热,并用玻璃棒不断搅拌;
E.用短颈玻璃漏斗趁热将溶液过滤到另一100mL的烧杯中;
F.过滤得苯甲酸晶体。
回答下列问题:
-
(1) 上述实验步骤的操作顺序为。
-
(2) 操作C的目的是。
-
(3) 操作E中要用到玻璃棒,其作用是。
-
(4) 操作A的温度(填“是”或“不是”)越低越好,理由是。
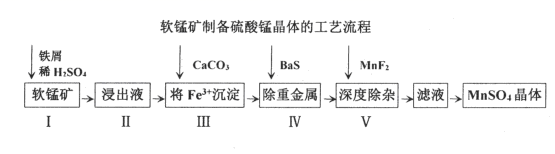
-
(1) I中加铁屑而不加铁块的原因是。
-
(2) 写出I中铁屑与软锰矿发生的主要反应的离子方程式。
-
(3) 加CaCO3之前需要加双氧水的作用,结合下表说明,加CaCO3控制溶液pH的范围是。
可能用到的数据如下:不同金属离子沉淀的pH
氢氧化物
Fe(OH)3
Fe(OH)2
Mn(OH)2
开始沉淀pH
1.5
6.5
7.7
沉淀完全pH
3.7
9.7
9.8
-
(4) 深度除杂中加入MnF2的作用。
-
(5) 从滤液中获取MnSO4晶体的方法是、趁热过滤。
硫酸锰在不同温度下的溶解度表
温度/℃
50
80
90
100
溶解度1(g/100g水)
58
48
42
34
-
(6) 为探究稀硫酸介质中湿法还原软锰矿制备硫酸锰的最佳工艺条件,研究了n(Fe)/n(MnO2)对锰浸出率η的影响。如图实验条件为n(H2SO4):n(MnO2)=2.1:1,反应温度为50℃,反应时间为80min。请结合图像分析n(Fe)/n(MnO2)约为最合适,并说出理由。

 B . 稀释浓硫酸
B . 稀释浓硫酸 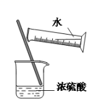 C . 蒸发NaCl溶液
C . 蒸发NaCl溶液  D . 分离CCl4和水
D . 分离CCl4和水 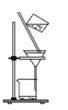
| 选项 | A | B | C | D |
| 实验 装置 | | | | |
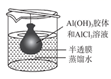
| 实验 目的 | 将干海带灼烧成灰 | 收集少量NO | 用于铜丝与Cl2反应,防污染 | 提纯Al(OH)3胶体 |
 B .
B .  C .
C .  D .
D . 
 )中含有
)中含有 杂质,为制得纯净的氯化铜晶体并测定其纯度,首先将其溶解在稀盐酸中,制成水溶液,再按下图所示的操作步骤进行提纯。
杂质,为制得纯净的氯化铜晶体并测定其纯度,首先将其溶解在稀盐酸中,制成水溶液,再按下图所示的操作步骤进行提纯。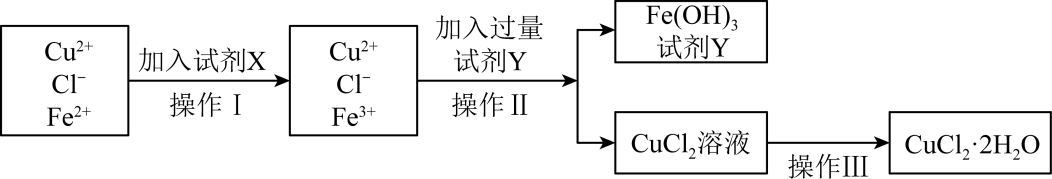
请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| 4.7 | 6.7 |
| 7.0 | 9.0 |
| 1.9 | 3.2 |
-
(1) 操作Ⅰ加入试剂X的目的是。
-
(2) 下列物质都可以作为试剂X,适合本实验的X物质可以是(填选项)____。A .
 B .
B . 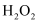 C . NaClO
D .
C . NaClO
D . 
-
(3) 操作Ⅱ加入过量试剂Y目的是调节溶液pH,试剂Y是(填化学式),调节溶液的pH范围是。
-
(4) 为了制得较纯净的氯化铜晶体,操作Ⅲ是:、冷却结晶、过滤、洗涤、干燥。
-
(5) 学习小组用“间接碘量法”测定
 晶体的的纯度(杂质不与
晶体的的纯度(杂质不与 反应),过程如下:取0.400g样品溶于水,加入过量KI固体充分反应,生成白色沉淀(
反应),过程如下:取0.400g样品溶于水,加入过量KI固体充分反应,生成白色沉淀( )。加入淀粉溶液作为指示剂,用
)。加入淀粉溶液作为指示剂,用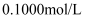
 标准溶液滴定(
标准溶液滴定( ),当溶液,即为终点,消耗
),当溶液,即为终点,消耗 标准溶液23.00mL,则样品纯度为%(保留1位小数,已知:
标准溶液23.00mL,则样品纯度为%(保留1位小数,已知: )。
)。

 。 制备苯乙酸的装置示意图如下(加热和夹持装置等略):
。 制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
在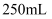 三颈烧瓶a中加入
三颈烧瓶a中加入 质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应。
质量分数为70%的硫酸和几片碎瓷片,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应。
回答下列问题:
-
(1) 在装置中仪器c的名称是,其作用是。
-
(2) 反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是。下列仪器中可用于分离苯乙酸粗品的是(填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
-
(3) 提纯粗苯乙酸的方法是,最终得到44g纯品,则苯乙酸的产率为。(保留两位有效数字)
-
(4) 苯乙酸铜是合成纳米氧化铜的重要前驱体之一。将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入
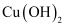 , 搅拌
, 搅拌 , 过滤。滤液静置一段时间可以析出苯乙酸铜晶体。混合溶剂中乙醇的作用是。写出此步发生反应的化学方程式。
, 过滤。滤液静置一段时间可以析出苯乙酸铜晶体。混合溶剂中乙醇的作用是。写出此步发生反应的化学方程式。