蒸发和结晶、重结晶 知识点题库
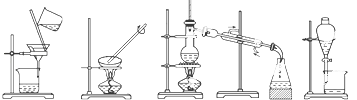
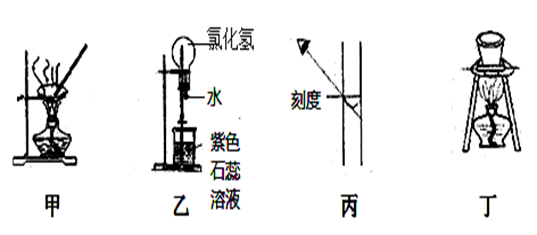
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
①配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度
②用10 mL的量筒量取4.80 mL的浓硫酸
③蒸发溶液时,边加热边搅拌,直至蒸发皿中的液体蒸干
④向无色溶液中加入BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO ![]()
⑤为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
⑥中和热测定的实验中使用的玻璃仪器只有2种
⑦实验室可利用浓氨水和碱石灰混合的方法制取少量氨气
⑧除去NO中混有的NO2气体可通过水洗,再干燥后用向上排空气法收集
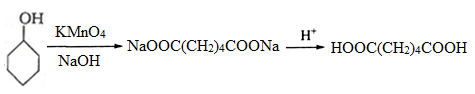
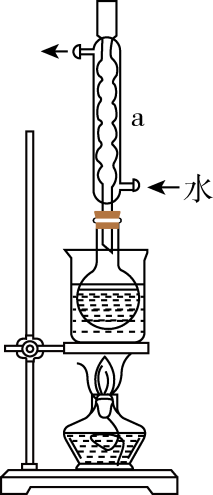
制备己二酸的装置示意图如图所示(加热和夹持装置等略)。
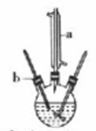
实验步骤:
I.己二酸的制备
连装好装置后,通过瓶口b慢慢滴加1.5g环已醇至适量KMnO4和NaOH的混合溶液中,然后塞上带有温度计的胶塞,再用沸水浴加热数分钟。
II.分离提纯
趁热过滤,收集滤液,用少量热水洗涤滤渣2次,合并滤液和洗涤液,边搅拌边滴加浓盐酸至溶液呈强酸性,小心加热蒸发浓缩至10mL左右,在冷水浴中冷却,析出已二酸粗品。
回答下列问题:
-
(1) 写出仪器a的名称:。
-
(2) 分离提纯过程中滴加的浓盐酸的作用是。
-
(3) 将已二酸粗品提纯的方法是_______________。A . 过滤 B . 萃取 C . 重结晶 D . 蒸馏
-
(4) 步骤II中过滤时需要用到的玻璃仪器有玻璃棒、。洗涤滤渣的目的是。
-
(5) 若制得纯已二酸的质量为1.5g,则己二酸的产率为。
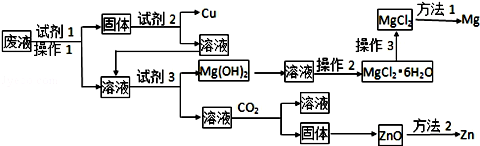
所用试剂在下列试剂中选择
①铁粉 ②锌粉 ③稀HNO3 ④稀H2SO4 ⑤稀HCl ⑥稀氨水 ⑦NaOH溶液 ⑧石灰水
请回答下列问题:(提示:锌的氧化物、氢氧化物性质与铝的相似)
-
(1) 试剂1、试剂2、试剂3分别可以是、、(填编号)
-
(2) 操作2是、、
-
(3) 操作3是

-
(1) 杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于上(用以下所给仪器的编号填入,下同),取用坩埚应使用,灼烧后的坩埚应放在上冷却,不能直接放在桌面上。
所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
-
(2) 杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是。
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
-
(3) 通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、、冷却结晶、、自然干燥。
-
(4) 由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是:、。
-
(5) 在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验中,若测定结果x值偏高,可能的原因是。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
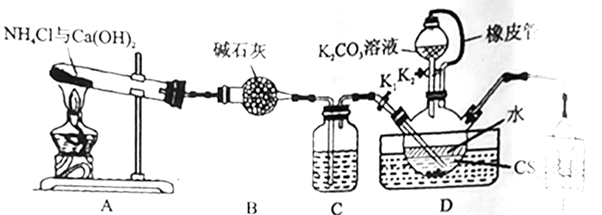
已知:①NH3不溶于CS2;
②在水溶液中,NH4HS、(NH4)2CO3受热易分解,NH4SCN在高于170℃时易分解;
③D中缓慢反应:CS2+3NH3  NH4HS+NH4SCN。
NH4HS+NH4SCN。
回答下列问题:
-
(1) 实验前应进行的操作是。实验中通过观察C中气泡速率,便于控制加热温度,装置C中的试剂最好选择(填标号)。
a.CS2 b.H2O c.浓硫酸
-
(2) 制备KSCN溶液:熄灭A处的酒精灯,关闭K1 , 使三颈烧瓶内液温在一段时间内维持在105℃,然后打开K2 , 继续保持液温105℃,缓缓滴入适量的K2CO3溶液。
①先加热一段时间,然后打开K2的目的是。
②写出装置D中生成KSCN的化学方程式:。
-
(3) 制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、、、洗涤、干燥,得到硫氰化钾晶体。
-
(4) 测定晶体中KSCN的含量:称取10.0g样品配成100mL溶液,再量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液,用0.1000mol/LAgNO3标准溶液滴定,重复2次滴定操作,滴定终点时消耗AgNO3标准溶液的体积如下表。已知:SCN-+Ag+=AgSCN↓(白色)
待测液的体积/mL
AgNO3标准溶液的体积/mL
第1次滴定
20.00
18.05
第2次滴定
20.00
20.10
第3次滴定
20.00
17.95
①将样品配成溶液时需用到的璃仪器有玻璃棒、烧杯、量筒、胶头滴管、。
②晶体中KSCN的质量分数为。
下列说法错误的是( )

| 选项 | 物质(杂质) | 方法 |
| A | | 在氧气流中灼烧 |
| B | | 加热升华 |
| C | HCl气体( | 通过KI溶液 |
| D | | 加入盐酸溶解、过滤、洗涤及干燥 |
| 选项 | 实例 | 分离方法 |
| A | 除去氯化钠溶液中的泥沙 | 过滤 |
| B | 用乙醚提取青蒿中的青蒿素 | 萃取 |
| C | 分离乙酸(沸点为118摄氏)与乙醚(沸点为34摄氏度) | 蒸馏 |
| D | 分离汽油和水的混合物 | 结晶 |
 和
和  之间形成共价键
D . 该生产原理利用的实验方法是蒸发结晶
之间形成共价键
D . 该生产原理利用的实验方法是蒸发结晶

-
(1) 从氯化钾溶液中得到氯化钾固体,选择装置。
-
(2) 氯化钠固体中混有碘,选择装置。
-
(3) 河水样品中加了少量明矾,选择装置。
-
(4) 除去自来水中的
 、
、  杂质离子,选择装置。
杂质离子,选择装置。
-
(5) 装置E在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是。
-
(1) Ⅰ.制备Na2S2O3•5H2O反应原理:Na2SO3(aq)+S(s)
 Na2S2O3(aq)
Na2S2O3(aq)实验步骤:
①称取15gNa2SO3加入圆底烧瓶中,再加入80mL蒸馏水。另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60min。回答下列问题:
硫粉在反应前用乙醇润湿的目的是。
-
(2) 仪器a的作用是。
-
(3) 产品中除了有未反应的Na2SO3外,是可能存在的无机杂质是,检验是否存在该杂质的方法是。
-
(4) Ⅱ.分离Na2S2O3•5H2O。已知:Na2S2O3•5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。
分离Na2S2O3•5H2O晶体的流程如图所示:





回答下列问题:
为减少产品的损失,操作①要(填操作),其目的是;操作②的包括的过程是快速过滤、洗涤、干燥,其中洗涤操作是用(填试剂)作洗涤剂。
-
(5) 蒸发浓缩滤液直至溶液为止,蒸发时要控制温度不宜过高原因。
-
(6) Ⅲ.研究外界条件对化学反应速率的影响,设计实验如表(所取溶液体积均为10mL):
实验编号
实验温度/℃
c(Na2S2O3)/mol·L-1
c(H2SO4)/mol·L-1
⑴
25
0.1
0.1
⑵
25
0.1
0.2
⑶
50
0.2
0.1
⑷
50
0.1
0.1
探究浓度对化学反应速率的影响,应选择(填实验编号)。
-
(7) 探究温度对化学反应速率的影响,应选择(填实验编号)。
 (炭粉)
(炭粉)
 )
)



