实验装置综合 知识点题库
 B .
B . 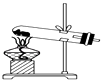 C .
C . 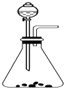 D .
D . 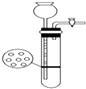
编号 | A | B | C | D |
实验 方案 |
|
|
|
|
实验 目的 | 配制溶液 | 分离溴的CCl4、水混合物 | Na2CO3、NaHCO3热稳定性比较 | 验证HCl极易溶于水 |
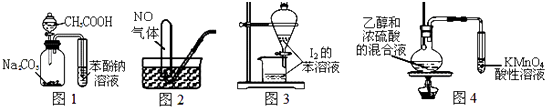
 B .
B . 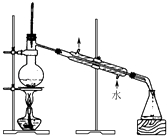 C .
C . 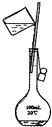 D .
D . 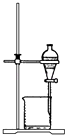
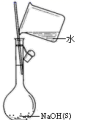
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
-
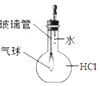
(1) (方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去).
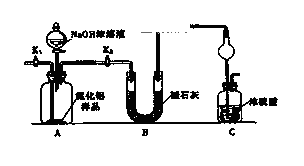
(i)图C装置中球形干燥管的作用是.
(ii)完成以下实验步骤:组装好实验装置,首先进行的操作是,再加入实验药品.接下来的实验操作是关闭,打开,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1 ,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是.
(iii)由于装置存在缺陷,导致测定结果偏高,请提出改进意见.
-
(2) (方案2)用下图装置测定m g样品中AlN的纯度(部分夹持装置已略去).
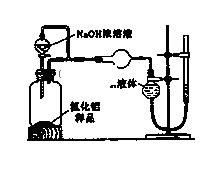
(i)为测定生成气体的体积,量气装置中的X液体可以是.
A.CCl4 B.H2O C.NH4Cl溶液 D.

(ii)若mg样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是.
-
(3) (方案3)按以下步骤测定样品中AlN的纯度

(i)步骤②生成沉淀的离子方程式为.
(ii)若在步骤③中未洗涤,测定结果将(填“偏高”、“偏低”或“无影响”).
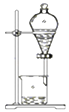
 B . 过滤
B . 过滤  C . 萃取
C . 萃取  D . 转移溶液
D . 转移溶液 
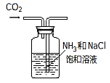 B .
B . 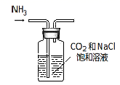 C .
C . 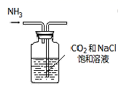 D .
D . 
| | | | |
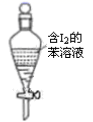
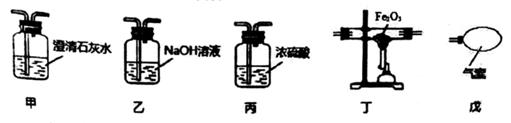
| A.配制0.10mol·L-1NaOH溶液 | B.向碘水中加入苯后振荡、静置 | C.实验室制取少量氯气 | D.实验室制取少量乙酸乙酯 |

-
(1) 仪器a的名称为,装置A中反应的离子方程式为。
-
(2) 试剂X的作用是。
-
(3) 装置D中通入干燥空气的作用是。
-
(4) 该实验装置的缺陷是。
I.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
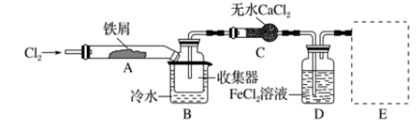
①检验装置的气密性
②通入干燥的Cl2 , 赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④……
⑤体系冷却后,停止通入Cl2 , 并用干燥的赶尽Cl2 , 将收集器密封
请回答下列问题:
-
(1) 写出实验室制取氯气的离子方程式。
装置A中反应的化学方程式为。
-
(2) 第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是。
-
(3) 操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)
-
(4) 装置B中冷水浴的作用为;装置C的名称为;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂
-
(5) FeCl3与H2S反应离子方程式为
-
(6) 综合分析实验II的两个反应,可知实验有两个显著优点:
①H2S的原子利用率为100%
②。
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42 ℃以上会分解生成Cl2和O2 , Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3 , 用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液。
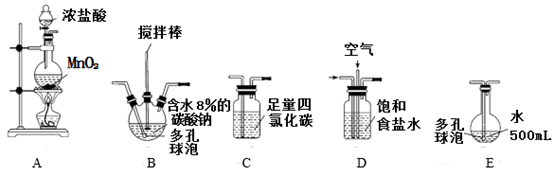
回答下列问题:
-
(1) 各装置的连接顺序为→→→→E。
-
(2) 装置A中反应的离子方程式是。
-
(3) 实验中控制氯气与空气体积比的方法是。
-
(4) 反应过程中,装置B需放在冷水中,其目的是。
-
(5) 装置E采用棕色圆底烧瓶是因为。
-
(6) 若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为g。
-
(7) 已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定E中次氯酸溶液的物质的量浓度的实验方案为:用准确量取20.00 mL次氯酸溶液,加入足量的溶液,再加入足量的溶液,过滤,洗涤,真空干燥,称量沉淀的质量。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。)
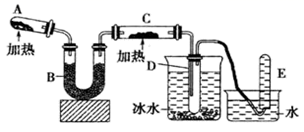
-
(1) 试管A中生成氨气反应的化学方程式是;
-
(2) B中加入的干燥剂是(填序号)
①浓硫酸②碱石灰③无水氯化钙;
-
(3) 能证明氨与氧化铜反应的现象
①C中、
②D中有无色液体生成;设计实验检验D中无色液体的成分:取少量液体于试管中,加入少量粉末,现象为。
-
(4) 写出氨气与氧化铜反应的化学方程式;若收集到22.4L(标况)氮气,计算转移电子数为。(用NA表示)
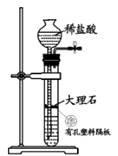 B . 除杂、干燥
B . 除杂、干燥  C . CO2与锌粉反应
C . CO2与锌粉反应  D . 检查 CO
D . 检查 CO 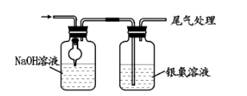

-
(1) 通入足量SO2时C中观察到的现象为。
-
(2) 根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42−。该做法(填“合理”或“不合理”),理由是。
-
(3) 为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。A . 浓硫酸 B . 酸性KMnO4溶液 C . 碘水 D . NaCl溶液
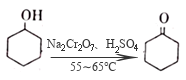
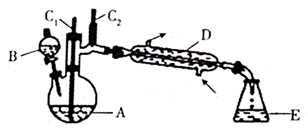
有关物质的物理性质见表。
|
物质 |
沸点(℃) |
密度(g·cm-3 , 20℃) |
溶解性 |
|
环己醇 |
161.1(97.8)* |
0.96 |
能溶于水和醚 |
|
环己酮 |
155.6(95.0)* |
0.95 |
微溶于水,能溶于醚 |
|
水 |
100.0 |
1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
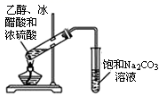
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
-
(1) 装置D的的名称是为。
-
(2) 酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致系体温度迅速上升,副反应增多。简述滴加酸性Na2Cr2O7溶液的方法;A中发生反应的离子方程式为。
-
(3) 环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的符合题意顺序是;
②d中往液体中加入NaCl固体的目的是;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有。
-
(4) 恢复至室温时,分离得到纯产品体积为8rnL,则环己酮的产率为(保留三个有效数字)。
-
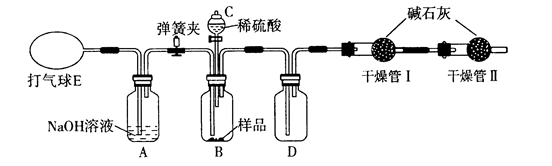
(1) I.现需要100mL 1.00mol/L NaCl溶液,按如下步骤进行配制:
①计算:需要NaCl固体g;
②称量:用天平精确称量所需要的NaCl固体;
③配制溶液:
④溶解:将称好的NaCl固体放入烧杯中,加入40mL的蒸馏水,用玻璃棒搅拌,使 NaCl固体全部溶解;
⑤转移:将烧杯中的溶液沿玻璃棒注入100mL容量瓶,并用少量蒸馏水洗涤烧杯内壁和 2~3次,将洗涤液也都注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀;
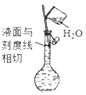
⑥定容:将蒸馏水注入容量瓶,当液面离刻度线1~2cm时,改用胶头滴管,滴加蒸馏水至,盖好瓶塞,反复上下颠倒,摇匀。
-
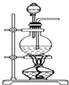
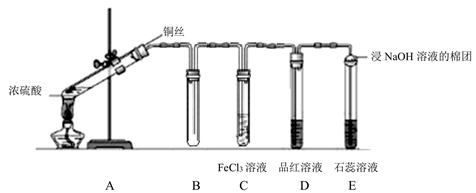
(2) II.为验证铜和浓硫酸发生反应,并检验气体产物的性质,实验装置图如下。
请回答:
浸NaOH溶液棉花团的作用;
-
(3) 下列叙述错误的是_______A . 铜丝下端卷成螺旋状的目的是增大反应接触面积 B . 气体通过D、E试管时的现象依次为溶液红色褪色、溶液先变红后褪色 C . 终止反应后,往试管里慢慢加入少量的水,溶液变成蓝色 D . 实验能说明浓硫酸中硫元素的氧化性强于氢元素
-
(4) 反应过程中,发现装置A试管内有黑色物质生成,经分析可能为Cu2S。产生Cu2S的反应为aCu+bH2SO4
 cCu2S+dCuSO4+eH2O,则a:b=。
cCu2S+dCuSO4+eH2O,则a:b=。

查阅资料:
I.磺酰氯遇水会发生水解反应,生成两种强酸:一种含氧酸、一种无氧酸。
II.磺酰氯在室温下较稳定,但在100℃以上时便会分解产成SO2和Cl2。
III.磺酰氯的熔点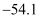 ℃、沸点69.1℃;H2SO4的熔点10.4℃、沸点338℃,不易分解。
℃、沸点69.1℃;H2SO4的熔点10.4℃、沸点338℃,不易分解。
回答下列问题:
-
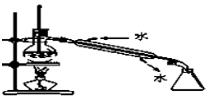
(1) 磺酰氯中硫元素的化合价为价;仪器B的名称是。
-
(2) 图甲A中的黑色固体是(填化学式);图乙B中发生反应的化学方程式为。
-
(3) 装置的组装顺序是a→→→,b→→→:仪器组装完毕后,进行实验前要先。
-
(4) C中的试剂为。戊中“气球”的作用是。
-
(5) 若缺少装置丙和丁,戊中所得产物反应的化学方程式为。
-
(6) 磺酰氯也可用氯磺酸(ClSO3H)分解获得,反应原理为:
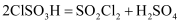 。
。①要从产物(假定氯磺酸已分解完全,下同)中获得纯净的磺酰氯,可采用的方法是;
②请设计实验证明该方法获得的产物中含有H2SO4:(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)。