实验装置综合 知识点题库

-
(1) 实验室里用乙醇和浓硫酸共热制取乙烯,(填“能”或“不能”)能否选用上述装置来完成实验;如果不能,应该选用哪种装置并在此装置上作什么改进即可完成该实验?.
-
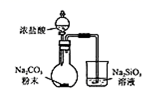
(2) 实验室制取HCl气体可选用A,用氯化钠和浓硫酸共热而得;若仅有浓硫酸与浓盐酸,选用装置也可以制取HCl气体,下列叙述不属于制取HCl气体理由的是
A、浓硫酸具有脱水性; B、浓硫酸具有吸水性
C、盐酸具有挥发性; D、气态物质的溶解性随温度的升高而降低
-
(3) 现有两种方法制取氧气,可供选用的药品有:KClO3、Na2O2、NaOH、H2O、Na2CO3、MnO2 . 若选装置B,则需选用的试剂为;若选装置C,则需选用的试剂为.
-
(4) 若把装置图1中的A与图2相连,在实验室可用来制取下列气体中的(填序号)
①NO2②Cl2 ③HCl ④NH3
写出实验室制取该气体的化学方程式:图2小烧杯所盛液体的作用为.
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:
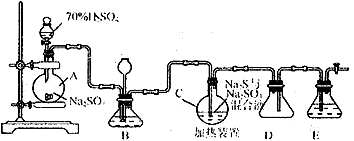
烧瓶C 中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S (aq) (Ⅰ)
2H2S (aq) +SO2(g)= 3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq)  Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
-
(1) 烧瓶A 中发生反应的离子方程式为。装置D的作用是。
-
(2) 装置B的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
-
(3) 反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
-
(4) 为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是。
-
(5) Ⅱ.焦亚硫酸钠(Na2S2O5) 是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
-
(6) 葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
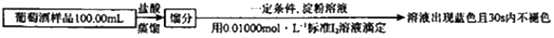
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为g/L
②在上述实验过程中,HI 可能会被空气氧化,反应的化学方程式为。若有部分HI 被空气氧化,会导致测得的结果(填“偏高”“ 偏低”或“不变”)。
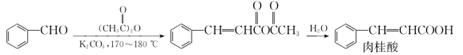
实验步骤:
步骤1在图1所示装置(夹持与加热仪器未画出,下同)的三颈烧瓶内加入K2CO3、苯甲醛(油状物)和乙酸酐,混合均匀后,在170 ℃~180 ℃加热反应1 h,冷却。
 图1
图1  图2
图2  图3
图3
步骤2向三颈烧瓶内分批加入20 mL水和Na2CO3固体,调节溶液pH约为8。
步骤3在三颈烧瓶中加入活性炭,用图2所示水蒸气蒸馏装置蒸馏除去未反应的苯甲醛。
步骤4将三颈烧瓶内反应混合物趁热过滤,滤液冷却至室温,用浓盐酸酸化至pH=3,析出大量晶体,抽滤。并用少量冷水洗涤晶体。
步骤5将晶体在图3所示热水浴上加热干燥。
-
(1) 图1中仪器A的作用是。
-
(2) 步骤2中Na2CO3需分批加入的原因是。
-
(3) 水蒸气蒸馏时,判断蒸馏结束的方法是。
-
(4) 步骤4中,“趁热过滤”的目的是。
-
(5) 抽滤时所需主要仪器有、安全瓶及抽气泵等。
-
(6) 与使用烘箱烘干相比,热水浴干燥的优点是。
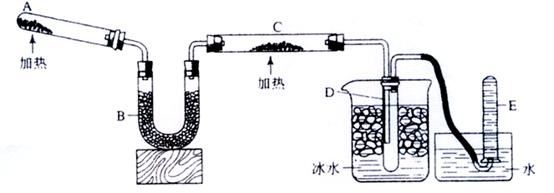
回答下列问题:
-
(1) A中加入的物质是.
发生反应的化学方程式是;
-
(2) B中加入的物质是,其作用是:
-
(3) 实验时在C中观察到得现象是,
发生反应的化学方程式是;
-
(4) 实验时在D中观察到得现象是,
D中收集到的物质是,检验该物质的方法和现象是.
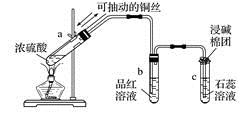
回答下列问题:
-
(1) 指出试管a、b、c中产生的实验现象:
①a中;
②b中;
③c中。
-
(2) 将a试管中的溶液慢慢倒入水中,发生的变化是。
-
(3) 写出浓硫酸与铜反应的化学方程式:。
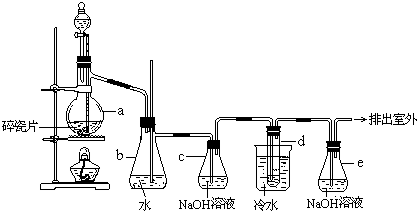
完成下列填空:
-
(1) 在此制备实验中,要尽可能迅速把反应温度升高到170℃左右,最主要目的是。
a. 引发反应 b. 加快反应速率 c. 防止乙醇挥发 d. 减少副产物乙醚生成
-
(2) 写出本题中制备1,2-二溴乙烷的两个化学反应方程式:;。
-
(3) 安全瓶b可以防止倒吸,并可以检验实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象。
-
(4) 容器c中NaOH溶液的作用是。
-
(5) 判断该制备反应已经结束的最简单方法是。
-
(6) 某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的一种原因。
![]()
请回答下列问题:
-
(1) “灼烧”前先将海带用酒精浸润,其目的是。
-
(2) “过滤”时除了烧杯外还需使用的玻璃仪器有。
-
(3) ①从环保角度及产物中不引人新的杂质方面考虑,“氧化”时最适合加入的氧化剂是 (填标号)。
A.氯气 B.硝酸 C.H2O2
②若使用上述选中的氧化剂在酸性条件下氧化,则发生反应的离子方程式为。
-
(4) 上述流程中涉及的实验操作不包括下列选项中的 (填标号)。A .
 B .
B .  C .
C .  D .
D . 
-
(5) 请设计一个简单的实验方案,检验加入CCl4萃取碘后的水层中是否还含有碘单质:。

回答下列问题:
-
(1) 实验甲在加热过程中能观察到产生白色沉淀的烧杯是(填“Ⅰ”或“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是, 通过实验甲可比较出(填“Na2CO3”或“NaHCO3”)更稳定。
-
(2) 实验乙用来验证Na2O2与CO2的反应,观察到的实验现象:包有Na2O2的棉花着火燃烧。棉花能着火燃烧,说明该反应特点是。
-
(3) 取10.0 g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0 g。则原混合物中碳酸钠的质量分数为。
 装置可验证酸性:
装置可验证酸性: 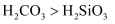 B . 图
B . 图  装置可用于收集气体
装置可用于收集气体 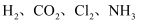 C . 图
C . 图  萃取碘水后的有机层和水层
D . 图
萃取碘水后的有机层和水层
D . 图  装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出
装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出
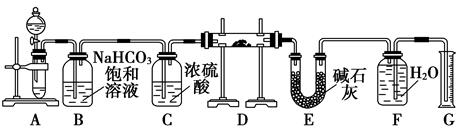
回答下列问题:
-
(1) 装置A中漏斗液体试剂选用,理由是。
-
(2) 装置B的作用是。装置C的作用是。装置E中碱石灰的作用是。
-
(3) 装置D中发生反应的化学方程式是。
-
(4) 若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(密度为
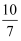 g/L),则Na2O2试样的纯度为。
g/L),则Na2O2试样的纯度为。
-
(1) 仪器G的名称是。
-
(2) 装置B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则装置C中反应的离子方程式,证明SO2具有氧化性的实验现象是。
-
(3) 为了实现绿色环保的目标,某同学设计装置F来代替装置A。与装置A相比,装置F的优点是(写出两点)。
-
(4) 若选用装置F制取O2可选用的试剂是。
 B . 收集NO2
B . 收集NO2 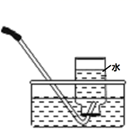 C . 制备SO2
C . 制备SO2 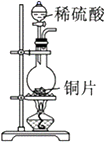 D . 除去Cl2中的HCl
D . 除去Cl2中的HCl 

 的作用是吸收挥发出的苯和溴蒸气
C . 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
D . 装置c中的碳酸钠溶液的作用是吸收溴化氢
的作用是吸收挥发出的苯和溴蒸气
C . 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
D . 装置c中的碳酸钠溶液的作用是吸收溴化氢
 NaClO3+5NaCl+3H2O,并设计如图制备NaClO溶液的装置:
NaClO3+5NaCl+3H2O,并设计如图制备NaClO溶液的装置: 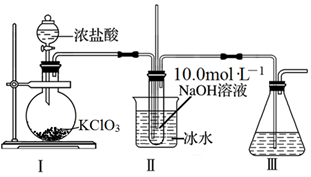
-
(1) 装置Ⅰ中烧瓶内发生反应的化学方程式为。
-
(2) 装置Ⅱ中用冰水浴控制温度的目的是;装置Ⅲ的作用是。
-
(3) 上述装置存在一处缺陷,会导致NaClO产率降低,改进的方法是。
-
(4) 用NaOH固体配制480mL10.0mol·L-1的NaOH溶液时,所需玻璃仪器除量筒、烧杯、胶头滴管外还需要。
-
(5) 配制上述NaOH溶液时,将称量好的NaOH固体g放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容会导致结果(填“偏大”、“不变”或“偏小”)。配制溶液的过程中定容时的操作是。
-
(1) Ⅰ.如图所示是完成1,2-二氯乙烷某些性质的实验装置。
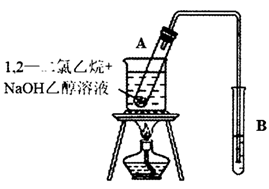
按图所示连接好仪器后,首先应进行的操作是。
-
(2) 在试管A里加入
 1,2-二氯乙烷和
1,2-二氯乙烷和 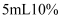 的
的  乙醇溶液,再向试管里加入几小块碎瓷片.加入碎瓷片的作用是。
乙醇溶液,再向试管里加入几小块碎瓷片.加入碎瓷片的作用是。
-
(3) 用水浴加热试管A里的混合物(其主要生成物仍为卤代烃,试管A中发生反应的化学方程式是,其反应类型是。
-
(4) 为检验产生的气体,可在试管B中盛放,现象是;向反应后试管A中的溶液里加入足量的稀硝酸,再加入几滴
 溶液,现象是。
溶液,现象是。
-
(5) Ⅱ.在制取乙酸乙酯中,有关浓硫酸的作用说法错误的是_______。A . 催化剂 B . 吸水剂 C . 脱水剂 D . 提高反应速率
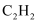 )为原料制备草酸晶体(
)为原料制备草酸晶体(  )装置如下:
)装置如下: 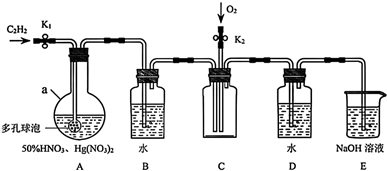
打开  ,装置A中的主反应为:
,装置A中的主反应为:  。
。
回答下列问题:
-
(1) 装置A最适宜的加热方式为,a的名称是,多孔球泡的作用是。
-
(2) 装置B中发生反应的化学方程式是。
-
(3) 反应一段时间后,打开
 ,通入
,通入  ,装置C中的现象是。
,装置C中的现象是。
-
(4) 装置B、D中得到的溶液可反复循环使用,理论上硝酸仅作为一种介质,则该实验总反应的化学方程式可表示为。
-
(5) 反应完毕,倒出a中溶液,经(填操作名称)、过滤得草酸晶体和
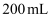 母液。
母液。
-
(6) 母液中草酸含量测定过程如下:量取
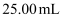 母液于锥形瓶中,用
母液于锥形瓶中,用 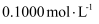 酸性
酸性  溶液滴定,平行实验三次,平均消耗
溶液滴定,平行实验三次,平均消耗  溶液
溶液 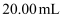 。(滴定反应的定量关系为:
。(滴定反应的定量关系为:  )
) ①量取
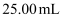 母液的仪器是滴定管(填“酸式”或“碱式”)。
母液的仪器是滴定管(填“酸式”或“碱式”)。②
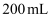 母液中含草酸的物质的量为
母液中含草酸的物质的量为  。
。
-
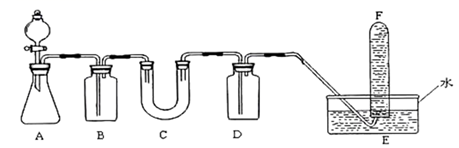
(1) 仪器C的名称是。
-
(2) 若分液漏斗中盛放的试剂是盐酸,为了除去混合气体中的氯化氢,装置B中盛放的试剂是。
-
(3) C中可能发生的化学反应的化学方程式为。
-
(4) D中盛放的试剂作用是。
-
(5) 检验F中收集到的气体的方法是。
-
(1) 小方拟用H2O2与H2S反应,则氧化剂与还原剂的物质的量之比为。
-
(2) 小明结合已有知识,计划选用Cl2与H2S反应。在讨论设计实验方案时,小组同学提出两种方案:
方案I:用干燥Cl2与H2S反应
方案II:用潮湿的Cl2与H2S反应
小组同学设计了以下实验装置并动手实验、验证方案:
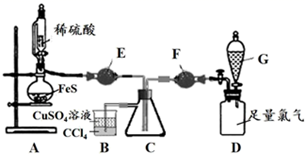
①证明以上装置气密性良好的具体操作是。
②仪器E的名称是。
③装置B的作用是。(答2点)
实验序号
实验操作
实验现象
结论
I
滴加稀硫酸,使H2S充满C瓶④ , 再打开G中的旋塞,缓慢通入Cl2至过量⑤。
C中有淡黄色固体产生,Cl2通入过量,淡黄色固体不消失。
淡黄色固体为单质硫,不会与过量的氯气反应。
II
撤去E、F装置,在C中加入少量水,先向C瓶通入H2S,再通入Cl2至过量。
C中看到淡黄色浑浊,通入Cl2过量,淡黄色沉淀消失⑥。
有水存在时,淡黄色固体会与过量氯气进一步反应。
④E中的试剂是。先通H2S排出装置中的空气,证明H2S已充满的现象是 (用离子方程式表示)。
⑤G中的试剂是。通过什么现象判断氯气已过量?。
⑥分析与讨论:实验II中黄色沉淀消失是S元素转变成了 (填离子符号),证明推测合理的实验操作和现象是:。
实验结论:-2→0硫元素的转化,氧化剂的选择、用量和反应环境均会影响结果。
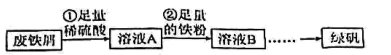
-
(1) 步骤①需要加热,温度保持80~95℃,采用的合适加热方式是。
-
(2) 铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为___(填标号)。A .
 B .
B .  C .
C .  D .
D . 
-
(3) 为检验步骤②是否反应完成,可选用的化学试剂是。
-
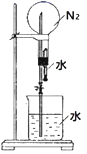
(4) 为测定绿矾中结晶水含量、将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置A称重,记为bg。按如图连接好装置进行实验。
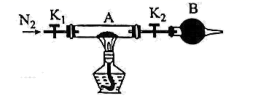
①仪器B的作用是。
②打开K1和K2 , 缓缓通入N2 , 加热,直至A恒重,记为cg。根据实验记录,计算绿矾化学式中结晶水数目x=(列计算式)。
-
(5) 为探究硫酸亚铁的分解产物,将(4)中已恒重的装置A接入如图所示的装置中,打开K1和K2 , 缓缓通入,加热,产生两种酸性气体。实验后反应管中残留固体为红色粉末。
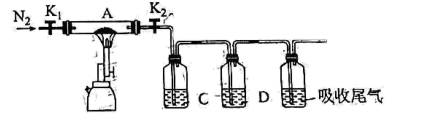
①C、D中的溶液依次为、(填标号)。
a.浓H2SO4 b.品红 c.NaOH d.BaCl2 e.Ba(NO3)2
②写出FeSO4·xH2O高温分解反应的化学方程式。



