氧化性、还原性强弱的比较 知识点题库
各组性质比较的表示中,正确的是 ( )。
A . 酸性:HI < HBr < HCl < HF
B . 稳定性:HF< HCl < HBr < HI
C . 氧化性:F2 < Cl2 < Br2 < I2
D . 沸点:F2 < Cl2 < Br2 < I2
已知Co2O3在酸性溶液中易被还原成Co2+ , Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A . 2Fe3++2I-===2Fe2++I2
B . Cl2+FeI2===FeCl2+I2
C . Co2O3+6HCl===2CoCl2+Cl2↑+3H2O
D . 3Cl2+6FeI2===2FeCl3+4FeI3
在KClO3+HCl→KCl+Cl2↑+H2O的反应中(未配平):
① 元素被氧化, 元素被还原(以上两空均填元素符号).
②配平该反应并用双线桥标出电子转移的方向和数目 .
下列说法不正确的是( )
A . 氧化性(酸性溶液):PbO2>Fe3+>S
B . 还原性(碱性溶液):Fe(OH)2>KCl>Cl2
C . 酸性(水溶液):H2S>H2SO4>H2SeO4>HN3
D . 热稳定性:CaCO3>FeCO3>Ag2CO3
下列根据实验操作或现象得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | KBrO3溶液中加入少量苯,然后通入少量Cl2 , 有机相呈橙色 | 氧化性:Cl2>Br2 |
B | 室温下,向浓度均为0.1mol•L-1的KCl和KI混合溶液中滴加几滴AgNO3溶液,只出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
C | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀。 | Y中不含有醛基 |
D | 已知NaClO2溶液的pH>7,将其蒸干并灼烧得到固体残留物。 | 该固体为NaClO2 |
A . A
B . B
C . C
D . D
已知:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+ , 由此可判断有关离子的还原性从强到弱的顺序是( )
A . Br->Fe2+>I-
B . I->Fe2+>Br-
C . Br->I->Fe2+
D . Fe2+>I->Br-
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各离子的物质的量变化如下图所示。
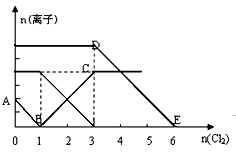
则有关说法错误的是( )
A . 线段BC代表Fe3+物质的量的变化
B . 原混合溶液中n(FeBr2)=3mol
C . 通入2mol Cl2反应的离子方程式为:2Fe2++6I-+4Cl2=2Fe3++3I2+8Cl-
D . 原溶液中 n(Fe2+): n(I-): n(Br-)=2 : 1 : 3
根据下面两个化学方程式判断Fe2+、Cu2+、Fe3+氧化性由强到弱的顺序是( )
①2FeCl3+Cu=2FeCl2+CuCl2 ②CuCl2+Fe=FeCl2+Cu
A . Fe3+>Cu2+>Fe2+
B . Fe2+>Cu2+>Fe3+
C . Cu2+>Fe3+>Fe2+
D . Fe3+>Fe2+>Cu2+
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A . 在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32-
B . 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C . 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
D . 在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+
Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
-
(1) 浓盐酸在反应中显示出来的性质是________(填写字母)A . 只有还原性 B . 还原性和酸性 C . 只有氧化性 D . 氧化性和酸性
-
(2) (2)产生0.3molCl2 , 则转移的电子的物质的量为;
-
(3) 该反应中氧化产物与还原产物的质量比为;
-
(4) 用双线桥法表示该氧化还原反应中电子转移的方向和数目
-
(5) 铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:
①Tl3++2Ag=Tl++2Ag+ , ②Ag++Fe2+=Ag+Fe3+ , ③Fe+2Fe3+=3Fe2+ , 下列离子氧化性比较顺序正确的是__________ (填写字母)
A . Tl3+>Fe3+>Ag+ B . Fe3+>Ag+>Tl3+ C . Tl+>Ag+>Fe2+ D . Tl3+>Ag+>Fe3+
BrCl的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,也可以与水发生如下反应:BrCl+H2O=HCl+HBrO,下列说法正确的是( )
A . BrCl与Ca(OH)2溶液反应,产物有CaBr2、Ca(ClO)2和H2O
B . BrCl与水反应时,水既是氧化剂又是还原剂
C . BrCl与钠反应,化学方程式是2Na+BrCl=NaCl+NaBr
D . BrCl与铁反应,化学方程式是2Fe+2BrCl=FeCl2+FeBr2
制备单质硅时,主要发生化学反应:① 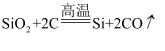 ;②
;②  ;③
;③  。下列对这三个反应的叙述错误的是( )
。下列对这三个反应的叙述错误的是( )
 ;②
;②  ;③
;③  。下列对这三个反应的叙述错误的是( )
。下列对这三个反应的叙述错误的是( )
A . ①③为置换反应
B . ①②③均为氧化还原反应
C . ②为化合反应
D . 三个反应的反应物中硅元素均被氧化
下列物质与水反应时,表现出的性质与其它物质不一样的是( )
A . Na
B . Cl2
C . NO2
D . Na2O2
根据下列反应判断物质的氧化性强弱,其中排序正确的是( )
① 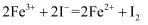
② 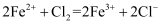
③ 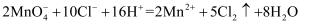
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
高铁酸钠(Na2FeO4)是水处理过程中的一种新型的绿色多功能净水剂。其净水过程中所发生的化学反应主要为 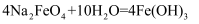 (胶体)
(胶体) 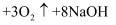 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
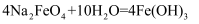 (胶体)
(胶体) 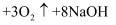 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
-
(1) 高铁酸钠(Na2FeO4)属于(“酸”、“碱”、“盐”或“氧化物”),其中铁的化合价为价;与O2互为同素异形体的物质的化学式为。
-
(2) 将上述反应的化学方程式改写成离子方程式:,该反应中的O2为(填标号)。
a.氧化产物 b.还原产物 c.既不是氧化产物又不是还原产物
-
(3) 实验室制备
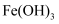 胶体的操作:向烧杯中加入40mL蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴(填化学式)饱和溶液,继续煮沸至液体呈色,停止加热。
胶体的操作:向烧杯中加入40mL蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴(填化学式)饱和溶液,继续煮沸至液体呈色,停止加热。
-
(4) 当生成48g O2时,至少有g水参与反应,生成的NaOH的质量为g。
为了防止枪支生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为:  。下列有关的叙述错误的是( )
。下列有关的叙述错误的是( )
 。下列有关的叙述错误的是( )
。下列有关的叙述错误的是( )
A .  的氧化性大于
的氧化性大于  的氧化性
B . 反应中转移电子2mol,则生成还原产物0.5mol
C . 枪支“发蓝”实质上是使铁表面钝化导致难以生锈
D . 上述反应中,单质铁被氧化,而NaNO2作为氧化剂
的氧化性
B . 反应中转移电子2mol,则生成还原产物0.5mol
C . 枪支“发蓝”实质上是使铁表面钝化导致难以生锈
D . 上述反应中,单质铁被氧化,而NaNO2作为氧化剂
 的氧化性大于
的氧化性大于  的氧化性
B . 反应中转移电子2mol,则生成还原产物0.5mol
C . 枪支“发蓝”实质上是使铁表面钝化导致难以生锈
D . 上述反应中,单质铁被氧化,而NaNO2作为氧化剂
的氧化性
B . 反应中转移电子2mol,则生成还原产物0.5mol
C . 枪支“发蓝”实质上是使铁表面钝化导致难以生锈
D . 上述反应中,单质铁被氧化,而NaNO2作为氧化剂
为实现下列物质间的转化,需要加入还原剂才能实现的是( )
A . SO3→H2SO4
B . Fe→FeCl3
C . CuO→Cu
D . Na→Na2O2
溴及其化合物可被用来作为阻燃剂、净水剂、染料等,海水中含有大量的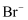 , 从海水中提取溴的过程中涉及反应
, 从海水中提取溴的过程中涉及反应 , 下列关于这一反应的说法错误的是。( )
, 下列关于这一反应的说法错误的是。( )
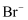 , 从海水中提取溴的过程中涉及反应
, 从海水中提取溴的过程中涉及反应 , 下列关于这一反应的说法错误的是。( )
, 下列关于这一反应的说法错误的是。( )
A . 该反应属于氧化还原反应
B . 生成物 既是氧化产物又是还原产物
C . 氧化性:
既是氧化产物又是还原产物
C . 氧化性: D . 氧化剂和还原剂的化学计量系数之比为
D . 氧化剂和还原剂的化学计量系数之比为
 既是氧化产物又是还原产物
C . 氧化性:
既是氧化产物又是还原产物
C . 氧化性: D . 氧化剂和还原剂的化学计量系数之比为
D . 氧化剂和还原剂的化学计量系数之比为
化学是一门以实验为基础的学科。下列所选试剂(或操作)和实验装置合理的是( )
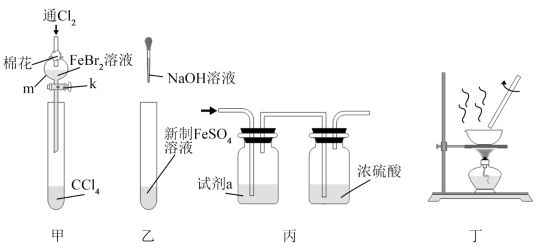
选项 | 实验目的 | 选用试剂(或操作) | 实验装置 |
A | 验证Fe2+和Br-的还原性强弱 | 取适量FeBr2溶液,通入少量Cl2(不能与任何微粒完全反应),一段时间后,将溶液放入CCl4中摇匀、静置 | 甲 |
B | 制备氢氧化亚铁 | 取新制FeSO4溶液,滴加NaOH溶液 | 乙 |
C | 除去CO2中少量的SO2、H2O(g) | 试剂a为饱和碳酸钠溶液 | 丙 |
D | 制备AlCl3固体 | 蒸发AlCl3饱和溶液 | 丁 |
A . A
B . B
C . C
D . D
下图是某国化学教材中讲解氧化还原反应知识章节的插图,下列说法错误的是( )
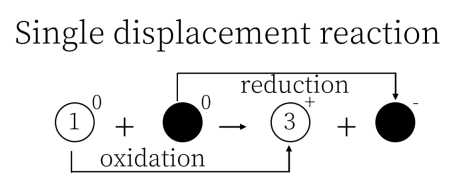
A . 英文单词“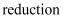 ”在这里是“还原”的意思
B . 物质1是还原剂,物质3是还原产物
C . 该反应可能是化合反应
D . 物质2的氧化性大于物质3
”在这里是“还原”的意思
B . 物质1是还原剂,物质3是还原产物
C . 该反应可能是化合反应
D . 物质2的氧化性大于物质3
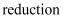 ”在这里是“还原”的意思
B . 物质1是还原剂,物质3是还原产物
C . 该反应可能是化合反应
D . 物质2的氧化性大于物质3
”在这里是“还原”的意思
B . 物质1是还原剂,物质3是还原产物
C . 该反应可能是化合反应
D . 物质2的氧化性大于物质3
最近更新



