氧化性、还原性强弱的比较 知识点题库
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O===H2SO4+2HI
2FeCl2+Cl2===2FeCl3
2FeCl3+2HI===2FeCl2+2HCl+I2
A . I->Fe2+>Cl->SO2
B . Cl->Fe2+>SO2>I-
C . Fe2+>I->Cl->SO2
D . SO2>I->Fe2+>Cl-
在一定条件下,下列微粒的还原性顺序为Cl﹣<Br﹣<Fe2+<I﹣<SO2 , 由此判断以下各反应在溶液中不能发生的是( )
A . 2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+
B . 2Fe2++Cl2═2Fe3++2Cl﹣
C . 2Br﹣+4H++SO42﹣═SO2+Br2+2H2O
D . I2+SO2+2H2O═4H++SO42﹣+2I﹣
已知:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4
下列结论正确的是( )
A . ①②③均是氧化还原反应
B . 氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2
C . 反应②中氧化剂与还原剂的物质的量之比为6∶1
D . 反应③中0.1 mol还原剂共失去电子数为6.02×1023
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
A . 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+
B . 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+
C . 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3
D . 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br- , ②2Br-+Cl2=Br2+2Cl- , ③2Fe3++2I-=2Fe2++I2。由此判断下列说法错误的是( )
A . 铁元素在反应①和③中均被氧化
B . 反应②中当有1 mol Cl2被还原时,有2mol Br-被氧化
C . 氧化性强弱顺序为:Cl2>Br2>Fe3+>I2
D . 还原性强弱顺序为:I->Fe2+>Br->Cl-
已知氧化性强弱顺序:Cl2> Br2> Fe3+>I2。下列反应不能发生的是( )
A . Br2+2I-= I2+2 Br-
B . 2FeCl2+Cl2 = 2FeCl3
C . 2FeCl2+2HCl+I2 = 2FeCl3+2HI
D . 2Fe3+ + 2I-= 2Fe2+ + I2
常温下,在溶液中可以发生反应X+2Y3+=2Y2++X2+ , 则下列叙述中①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强,正确的是( )
A . ②④⑥
B . ①③④
C . ①③⑤⑥
D . ②⑤
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是 ( )
①I2+SO2+2H2O=H2SO4+2HI ② 2FeCl2+Cl2=2FeCl3 ③2FeCl3+2HI=2FeCl2+2HCl+I2
A . I->Fe2+>Cl->SO2
B . Cl->Fe2+>SO2>I-
C . SO2>I->Fe2+>Cl-
D . Fe2+>I->Cl->SO2
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )
A . 上述实验中,共有两个氧化还原反应
B . 上述实验证明氧化性:  >Cl2>Fe3+>I2
C . 实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D . 实验②证明Fe2+既有氧化性又有还原性
>Cl2>Fe3+>I2
C . 实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D . 实验②证明Fe2+既有氧化性又有还原性
 >Cl2>Fe3+>I2
C . 实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D . 实验②证明Fe2+既有氧化性又有还原性
>Cl2>Fe3+>I2
C . 实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D . 实验②证明Fe2+既有氧化性又有还原性
二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。在回收过程当中涉及到如下化学反应:
①SeO2+4KI+4HNO3→Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O。下列有关叙述错误的是( )
A . 反应①中每有0.6mol I2生成,转移电子数目为1.2NA
B . ①中Se是还原产物,I2是氧化产物
C . 反应①中KI是氧化剂,SeO2是还原剂
D . SeO2、H2SO4(浓)、I2的还原性由强到弱的顺序是H2SO4(浓)>SeO2>I2
已知有如下氧化性强弱关系:H2O2>Fe3+>I2 , 下列反应能发生的是( )
A . 2Fe2++I2=2Fe3++2I-
B . 2Fe3++2I-=2Fe2++I2
C . H2O2+2I-+2H+=2H2O+I2
D . 2Fe3++2H2O=H2O2+2Fe2++2H+
PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A . Cu+2Fe3+=Cu2++2Fe2+
B . 10Cl-+2MnO4-+16H+=2Mn2++5Cl2↑+8H2O
C . 2Fe2++Cl2=2Fe3++2Cl-
D . 5Pb2++2MnO4-+2H2O=5PbO2+2Mn2++4H+
氢化钙(  )可在野外用作生氢剂,其中氢元素为-1价。
)可在野外用作生氢剂,其中氢元素为-1价。  用作生氢剂时的化学反应原理为:
用作生氢剂时的化学反应原理为:  。下列有关该反应的说法中,正确的是( )
。下列有关该反应的说法中,正确的是( )
 )可在野外用作生氢剂,其中氢元素为-1价。
)可在野外用作生氢剂,其中氢元素为-1价。  用作生氢剂时的化学反应原理为:
用作生氢剂时的化学反应原理为:  。下列有关该反应的说法中,正确的是( )
。下列有关该反应的说法中,正确的是( ) ①该反应属于复分解反应②  具有还原性③
具有还原性③  中的氢元素被还原④
中的氢元素被还原④  应保存在水中
应保存在水中
A . ①②
B . ②③
C . ③④
D . ①④
硫酸盐(含  、
、  )气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
)气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
 、
、  )气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:
)气溶胶是 PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下: 
下列说法错误的是( )
A . 该过程有 H2O 参与
B . NO2是生成硫酸盐的还原剂
C . 硫酸盐气溶胶呈酸性
D . 该过程中有硫氧键生成
已知:①Br2+2Fe2+=2Fe3++2Br-②Cl2+2Br-=Br2+2Cl-。下列说法错误的是( )
A . 向FeBr2溶液滴入少量新制氯水,Br-先被氧化
B . 向FeBr2溶液滴入少量新制氯水,Fe2+先被氧化
C . 2FeCl2+Cl2=2FeCl3反应能发生
D . 氧化性:Cl2>Br2>Fe3+
反应 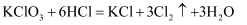 中,下列说法正确的是( )
中,下列说法正确的是( )
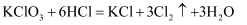 中,下列说法正确的是( )
中,下列说法正确的是( )
A . 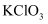 中的
中的 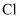 元素被氧化
B .
元素被氧化
B .  是还原产物
C . 氧化剂与还原剂的物质的量之比1:6
D . 氧化产物与还原产物的物质的量之比5:1
是还原产物
C . 氧化剂与还原剂的物质的量之比1:6
D . 氧化产物与还原产物的物质的量之比5:1
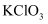 中的
中的 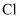 元素被氧化
B .
元素被氧化
B .  是还原产物
C . 氧化剂与还原剂的物质的量之比1:6
D . 氧化产物与还原产物的物质的量之比5:1
是还原产物
C . 氧化剂与还原剂的物质的量之比1:6
D . 氧化产物与还原产物的物质的量之比5:1
下列反应中,氯元素全部被氧化的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
某离子反应涉及  、
、 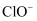 、
、  、
、  、
、  、
、  六种微粒。其中
六种微粒。其中  随反应的进行逐渐减小。下列判断错误的是( )
随反应的进行逐渐减小。下列判断错误的是( )
 、
、 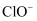 、
、  、
、  、
、  、
、  六种微粒。其中
六种微粒。其中  随反应的进行逐渐减小。下列判断错误的是( )
随反应的进行逐渐减小。下列判断错误的是( )
A . 反应中 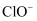 被还原
B . 反应后溶液的酸性明显增强
C . 氧化剂与还原剂的物质的量之比为
被还原
B . 反应后溶液的酸性明显增强
C . 氧化剂与还原剂的物质的量之比为 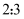 D . 反应消耗1mol氧化剂时,转移2mol电子
D . 反应消耗1mol氧化剂时,转移2mol电子
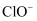 被还原
B . 反应后溶液的酸性明显增强
C . 氧化剂与还原剂的物质的量之比为
被还原
B . 反应后溶液的酸性明显增强
C . 氧化剂与还原剂的物质的量之比为 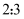 D . 反应消耗1mol氧化剂时,转移2mol电子
D . 反应消耗1mol氧化剂时,转移2mol电子
氧化还原反应在生产、生活中有广泛的应用,回答下列问题:
-
(1) 下列化学反应都与盐酸有关,其中盐酸既表现还原性又表现酸性的是(填标号)。
a.KClO3+6HCl=KCl+3Cl2↑+3H2O b.Zn+2HCl=ZnCl2+H2↑
c.2HCl
 H2↑+Cl2↑ d.AgNO3+HCl=AgCl+HNO3
H2↑+Cl2↑ d.AgNO3+HCl=AgCl+HNO3 -
(2) 向硫酸酸化的KMnO4溶液中滴加双氧水,溶液褪色同时伴有气泡冒出,该反应中氧化剂与还原剂的物质的量之比为,每转移0.3mol电子时,理论上能产生标准状况下气体体积为L。
-
(3) 某危险品仓库中存放有剧毒的化工原料氰化钠(NaCN),易潮解,易溶于水。已知N元素表现-3价,则C元素表现为价。一旦发生意外,工作人员需一方面封堵泄漏渠道,另一方面对已经泄露的少量氰化钠做无害化处理。下列物质中,可用于处理泄露的氰化钠的是(填标号)。
a.硫酸钾 b.臭氧(O3) c.氯化钠 d.双氧水
-
(4) 铀(U)元素在核工业中具有重要作用,工业上可利用钾、钙、镁等金属与铀矿石(主要成分二氧化铀)反应制得铀单质。若要获得等质量的铀单质,钾、钙、镁三种金属中,所耗金属质量最小的是。
我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
-
(1) 在该反应中,还原剂是(填化学式),KNO3发生了反应(填“氧化”或“还原”)。
-
(2) 烟花爆竹的成分中含有黑火药。点燃后,瞬间产生大量气体,同时释放大量热,在有限的空间里,气体受热迅速膨胀引起爆炸。反应中每消耗0.1molS,释放的气体体积为L(换算成标准状况)。
-
(3) 除了黑火药,烟花爆竹中常加入一些金属元素,燃烧时会产生五彩缤纷的火焰。下表为一些金属元素的焰色:
金属元素
钠
钾
钙
锶
钡
铜
火焰颜色
黄
紫
砖红
洋红
黄绿
绿色
若燃放烟花的火焰呈现紫色,则烟花中可能含有元素,该元素的离子结构示意图为。
最近更新



