氧化性、还原性强弱的比较 知识点题库
 B . NF3的氧化性大于F2
C . NF3分子空间构型为三角锥形
D . NH4F中既有离子键又有极性共价键
B . NF3的氧化性大于F2
C . NF3分子空间构型为三角锥形
D . NH4F中既有离子键又有极性共价键
 =1×10﹣12 , 溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH﹣)均增大
D . 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,不能说明Na2O2是否变质
=1×10﹣12 , 溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH﹣)均增大
D . 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,不能说明Na2O2是否变质
(2)发射火箭时若以肼作燃料,一氧化二氮(N2O)作氧化剂,两者反应生成对大气无污染、可参与大气循环的物质,写出反应的化学方程式: .
(3)N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是 .
A.该物质只具有氧化性
B.该物质的摩尔质量是152
C.15.2g该物质含有6.02×1023个原子
D.该物质既有氧化性又有还原性.
选项 | 已知 | 解释与结论 |
A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
C | 常温下,Ksp(AgCl)=1.8×10﹣10、 Ksp(AgBr)=5.4×10﹣13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时, |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
①Cl2+2KI═2KCl+I2
②2FeCl2+Cl2═2FeCl3
③2FeCl3+2KI═2FeCl2+2KCl+I2
④I2+SO2+2H2O═H2SO4+2HI.

-
(1) 被还原的元素是,还原剂是;
-
(2) 写出并配平该氧化还原反应方程式;
-
(3) 反应生成0.3mol H2O,则转移电子的数目为;
-
(4) 若反应后,氧化产物的化合价升高,而其他物质保持不变,则反应中氧化剂与还原剂的物质的量之比将(填“增大”“不变”“减小”或“不能确定”)。
 2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O
2Na+Cl2↑,②电解饱和食盐水制烧碱:2NaCl+2H2O  2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )
2NaOH+H2↑+Cl2↑,下列有关说法正确的是( )

K2Cr2O7+HCl(浓)→KCl+CrCl3+Cl2↑+H2O(未配平)
-
(1) (填元素名称)元素被氧化,(填化学式 , 下同)是氧化剂。
-
(2) 是氧化产物,发生氧化反应。
-
(3) 参加反应的盐酸,表现了性质。(填“还原性”“氧化性”或“酸性”)
-
(4) 该反应中每生成3分子Cl2转移电子个数为个。
-
(5) 配平上述反应,并用单线桥表示出该反应电子转移的方向和数目。

| 选项 | 化学反应方程式 | 相关说法 |
| A | | 氧气是氧化产物,氯酸钾既是氧化剂又是还原剂 |
| B | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| C | 4CuO | 该反应中每生成1molO2 , 则转移2NA个电子 |
| D | 2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑ | 氧化性:Na2O2>Na2FeO4>FeSO4 |
 ),应立即用2%硫酸铜溶液洗胃,其反应是:
),应立即用2%硫酸铜溶液洗胃,其反应是:
 , 下列说法正确的是( )
, 下列说法正确的是( )
 )只发生了氧化反应
B .
)只发生了氧化反应
B .  是还原产物
C . 氧化产物和还原产物的物质的量之比为
是还原产物
C . 氧化产物和还原产物的物质的量之比为 D .
D .  能氧化
能氧化
实验目的 | 实验过程 | |
A | 检验某溶液中是否含有SO | 取少量溶液于试管中,加入BaCl2溶液,出现白色沉淀,再加入足量盐酸,观察沉淀的变化 |
B | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
C | 探究H2O2氧化性比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,观察实验现象 |
D | 检验某固体试样是否含有Cl- | 取少量固体试样溶于水,先加入足量稀硝酸,再滴加AgNO3溶液,观察实验现象 |
 通入某NaClO溶液中,有
通入某NaClO溶液中,有 生成,说明该条件下氧化性:
生成,说明该条件下氧化性: C . 加热NaCl与浓
C . 加热NaCl与浓 的混合物可制得HCl,说明H2SO4的酸性比HCl的酸性强
D . 浓
的混合物可制得HCl,说明H2SO4的酸性比HCl的酸性强
D . 浓 和稀
和稀 与Cu反应的还原产物分别为
与Cu反应的还原产物分别为 和NO,说明稀
和NO,说明稀 的氧化性更强
的氧化性更强
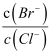 =3×10﹣3
=3×10﹣3




