氧化性、还原性强弱的比较 知识点题库
已知I﹣、Fe2+、SO2和H2O2均有还原性,在酸性溶液中还原能力的强弱顺序为:H2O2<Fe2+<I﹣<SO2 , 则下列反应不能发生的是( )
A . 2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+
B . H2O2+H2SO4═SO2↑+O2↑+2H2O
C . I2+SO2+2H2O═H2SO4+2HI
D . 2Fe3++2I﹣═2Fe2++I2
已知:还原性强弱:I﹣>Fe2+ . 往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+ . 则原碘化亚铁溶液的物质的量浓度为( )
A . 0.12mol•L﹣1
B . 0.1mol•L﹣1
C . 1.2mol•L﹣1
D . 1.0mol•L﹣1
某化学小组探究酸性条件下NO3﹣、SO42﹣、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)

实验记录如表:
实验序号 | 实验操作 | 实验现象 |
I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a | A中浅绿色溶液最终变为黄色. |
IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中通入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
请回答下列问题:
-
(1) 配制FeCl3溶液时,常常加入盐酸,目的是(用化学方程式和简单文字叙述):.
-
(2) 资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+ , 反应方程式为:Fe3++6SO2⇌Fe(SO2)63+ . 请用化学平衡移动原理解释实验I中溶液颜色变化的原因.
-
(3) 实验II中发生反应的离子方程式是.
-
(4) 实验III中,浅绿色溶液变为黄色的原因是(用离子方程式表示).
-
(5) 实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是.
-
(6) 综合上述实验得出的结论是:在酸性条件下,NO3﹣、SO42﹣、Fe3+三种微粒的氧化性由强到弱的顺序是:.
已知反应①2BrO3- + Cl2 =Br2 +2ClO3- ②5Cl2 + I2 +6H2O=2HIO3 +10HCl
③ClO3- +5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是( )
A . ClO3->BrO3->IO3->Cl2
B . BrO3- >Cl2>ClO3->IO3-
C . BrO3->ClO3->Cl2>IO3-
D . Cl2>BrO3->ClO3->IO3-
已知只有符合以下规律的氧化还原反应才能够自发进行,即氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。若下面三个离子反应都能发生:2A-+C2=2C-+A2 , 2C-+B2=2B-+C2 , 2X-+C2=2C-+X2 , 则下列有关说法中错误的是( )
A . 氧化性B2>C2>A2
B . X2与B- 能发生反应
C . 氧化性B2>C2>X2
D . 还原性X- >C- >B-
已知反应:①Cl2+2KBr=2KCl+Br2 , ②KClO3+6HCl=3Cl2↑+KCl+3H2O。据此判断下列说法正确的是( )
A . 上述两个反应都是置换反应
B . ①中KCl是氧化产物,KBr发生还原反应
C . 反应②中还原剂与氧化剂的物质的量之比为5: 1
D . 氧化性由强到弱的顺序为:Br2>Cl2>KClO3
盐酸能发生下列反应:①Zn+2HCl=ZnCl2+H2↑,②2HCl+CuO=CuCl2+H2O③MnO2+4HCl  MnCl2+Cl2↑+2H2O,因此盐酸应具有的性质是( )
MnCl2+Cl2↑+2H2O,因此盐酸应具有的性质是( )
 MnCl2+Cl2↑+2H2O,因此盐酸应具有的性质是( )
MnCl2+Cl2↑+2H2O,因此盐酸应具有的性质是( )
A . 有酸性、氧化性和还原性
B . 只有氧化性
C . 只有还原性
D . 只有酸性
复印机工作时易产生臭氧,臭氧浓度过高时对人体有害.臭氧具有强氧化性,可使润湿的KI-淀粉试纸变蓝.有关反应式为:O3+2KI+H2O=2KOH+I2+O2对此下列说法正确的是( )
A . 反应中1mol O3得到4mol电子
B . 反应中O3是氧化剂,H2O与KI是还原剂
C . 氧化产物I2与还原产物KOH的物质的量之比是1:1
D . 由此反应知,氧化性强弱顺序是O3>I2>O2
下列反应中,水作氧化剂的是( )
A . C+H2O=CO+H2
B . H2+CuO=Cu+H2O
C . Cl2+H2O=HCl+HClO
D . SO3+H2O=H2SO4
2020年8月初,黎巴嫩首都贝鲁特港口发生大规模爆炸,该爆炸是由于储存在仓库的2750吨硝酸铵引起的。已知爆炸时硝酸铵按下式分解:4NH4NO3=3N2↑+2NO2↑+8H2O↑,则该反应中被氧化和被还原的N原子数之比为( )
A . 1∶1
B . 1∶2
C . 1∶3
D . 3∶1
过氧化氢(H2O2 , 氧显-1价)俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。

根据下列反应回答问题:
A.Ag2O+H2O2=2Ag+O2↑+H2O
B.2H2O2=2H2O+O2↑
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
-
(1) 上述反应中,H2O2分别表现性质。
-
(2) 上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序。
-
(3) 某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式为。
下列变化必须加入其他物质作还原剂才能发生的是( )
A . CuO  CuCl2
B . CO2
CuCl2
B . CO2  CO
C . I-
CO
C . I-  I2
D . H2O
I2
D . H2O  H2
H2
 CuCl2
B . CO2
CuCl2
B . CO2  CO
C . I-
CO
C . I-  I2
D . H2O
I2
D . H2O  H2
H2
反应3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3中,氧化剂与还原剂的物质的量之比是( )
A . 4:3
B . 3:4
C . 1:3
D . 2:1
已知  (浓)
(浓)  (未配平).如图
(未配平).如图  是浸有相关溶液的滤纸,向
是浸有相关溶液的滤纸,向  晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.下列有关说法错误的是( )
晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.下列有关说法错误的是( )
 (浓)
(浓)  (未配平).如图
(未配平).如图  是浸有相关溶液的滤纸,向
是浸有相关溶液的滤纸,向  晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.下列有关说法错误的是( )
晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.下列有关说法错误的是( ) 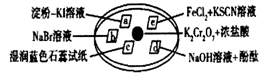
A . a处变蓝、b处变棕红,说明非金属性: 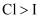 、
、 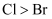 B . d处立即褪色是因为
B . d处立即褪色是因为  的漂白作用,e处变红可用于检验
的漂白作用,e处变红可用于检验  C . c处先变红后褪色说明
C . c处先变红后褪色说明  与
与  反应生成
反应生成  和
和  D . 已知反应中氧化剂与还原剂的物质的量之比为
D . 已知反应中氧化剂与还原剂的物质的量之比为 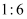
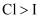 、
、 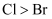 B . d处立即褪色是因为
B . d处立即褪色是因为  的漂白作用,e处变红可用于检验
的漂白作用,e处变红可用于检验  C . c处先变红后褪色说明
C . c处先变红后褪色说明  与
与  反应生成
反应生成  和
和  D . 已知反应中氧化剂与还原剂的物质的量之比为
D . 已知反应中氧化剂与还原剂的物质的量之比为 
亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如图所示:

已知:
①纯ClO2 易分解爆炸,空气中ClO2 的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
-
(1) 试剂A 可以选择(填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
-
(2) 反应Ⅱ的离子方程式为。
-
(3) 下列关于上述流程的说法中,合理的是(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
-
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是。
-
(5) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN,其中N化合价为-3价),得到无毒的NaCl、N2和CO2。请写出该反应的化学方程式,,指出氧化剂被氧化的元素氧化产物
需加入适当的氧化剂才能实现的反应是:( )
A . PCl3→PCl5
B . MnO2→Mn2+
C . SO2→SO  D . Fe2O3→Fe
D . Fe2O3→Fe
 D . Fe2O3→Fe
D . Fe2O3→Fe
有下列三个反应:下列说法正确的是( )



A . 反应  中的氧化产物分别是
中的氧化产物分别是  、
、  、
、  B . 根据以上方程式可以得到氧化性:
B . 根据以上方程式可以得到氧化性:  C . 在反应
C . 在反应  中当1 mol
中当1 mol  参加反应时,2 mol HCl被氧化
D . 可以推理得到
参加反应时,2 mol HCl被氧化
D . 可以推理得到 
 中的氧化产物分别是
中的氧化产物分别是  、
、  、
、  B . 根据以上方程式可以得到氧化性:
B . 根据以上方程式可以得到氧化性:  C . 在反应
C . 在反应 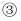 中当1 mol
中当1 mol  参加反应时,2 mol HCl被氧化
D . 可以推理得到
参加反应时,2 mol HCl被氧化
D . 可以推理得到 
钒元素在酸性溶液中有多种存在形式,其中VO2+为蓝色,VO  为淡黄色,VO
为淡黄色,VO  具有较强的氧化性,浓盐酸能把VO
具有较强的氧化性,浓盐酸能把VO  还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
 为淡黄色,VO
为淡黄色,VO  具有较强的氧化性,浓盐酸能把VO
具有较强的氧化性,浓盐酸能把VO  还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
A . 在酸性溶液中氧化性:VO  >
>  >Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO
>Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO  +4H++2Cl-=2VO2++Cl2↑+2H2O
+4H++2Cl-=2VO2++Cl2↑+2H2O
 >
>  >Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO
>Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO  +4H++2Cl-=2VO2++Cl2↑+2H2O
+4H++2Cl-=2VO2++Cl2↑+2H2O
工业上利用反应  检查氯气管道是否漏气。下列说法错误的是( )
检查氯气管道是否漏气。下列说法错误的是( )
 检查氯气管道是否漏气。下列说法错误的是( )
检查氯气管道是否漏气。下列说法错误的是( )
A . 将浓氨水接近管道,若产生白烟说明管道漏气
B .  的电子式为:
的电子式为:  C .
C .  中只含有离子键
D . 该反应中氧化剂和还原剂的物质的量之比为
中只含有离子键
D . 该反应中氧化剂和还原剂的物质的量之比为 
 的电子式为:
的电子式为:  中只含有离子键
D . 该反应中氧化剂和还原剂的物质的量之比为
中只含有离子键
D . 该反应中氧化剂和还原剂的物质的量之比为 
已知有如下反应:① ②
② ③
③ 根据上述反应,判断下列结论中正确的是( )
根据上述反应,判断下列结论中正确的是( )
 ②
② ③
③ 根据上述反应,判断下列结论中正确的是( )
根据上述反应,判断下列结论中正确的是( )
A . Cl2在反应②中只是氧化产物
B . Cl2在①③反应中均做氧化剂
C . 氧化性强弱的顺序为: D . 溶液中可发生:
D . 溶液中可发生:
 D . 溶液中可发生:
D . 溶液中可发生:
最近更新



