й“қзҡ„еҢ–еӯҰжҖ§иҙЁ зҹҘиҜҶзӮ№йўҳеә“
пјҲ1пјүзҪҗеЈҒеҶ…еҮ№иҖҢзҳӘзҡ„еҺҹеӣ пјҡгҖҖ зҰ»еӯҗж–№зЁӢејҸпјҡ гҖҖ
пјҲ2пјүзҪҗеЈҒйҮҚж–°йј“иө·зҡ„еҺҹеӣ пјҡ зҰ»еӯҗж–№зЁӢејҸпјҡ пјҺ
пјҲ1пјүй“қе…ғзҙ жүҖеңЁе‘Ёжңҹзҡ„еҗ„е…ғзҙ еҪўжҲҗзҡ„з®ҖеҚ•зҰ»еӯҗдёӯеҚҠеҫ„жңҖе°Ҹзҡ„жҳҜ пјҺпјҲеЎ«зҰ»еӯҗз¬ҰеҸ·пјүпјҺ
пјҲ2пјүжҳҺзҹҫ[KAlпјҲSO4пјү2]жҳҜдёҖз§Қж··еҮқеүӮпјҢж¬Ўж°Ҝй…ёй’ жҳҜдёҖз§Қеёёз”Ёзҡ„ж¶ҲжҜ’еүӮпјҢдәҢиҖ…зҡ„ж°ҙжә¶ж¶Іж··еҗҲж—¶дә§з”ҹзҷҪиүІжІүж·ҖпјҢеҶҷеҮәеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖҖ пјҺ
пјҲ3пјүж°®еҢ–й“қпјҲAlNпјүе’Ңж°®еҢ–зЎјз»“жһ„зӣёдјјпјҢйғҪжҳҜе…·жңүдјҳиүҜжҖ§иғҪзҡ„ж–°еһӢжқҗж–ҷпјҢдәҢиҖ…зӣёжҜ”иҫғпјҢзҶ”зӮ№иҫғй«ҳзҡ„жҳҜ пјҺ
пјҲ4пјүе·ҘдёҡдёҠеёёз”Ёй“қеңҹзҹҝпјҲеҗ«SiO2зӯүжқӮиҙЁпјүз”ҹдә§й“қпјҺд»ҺNa2SiO3е’ҢNaAlO2ж··еҗҲжә¶ж¶ІдёӯеҲ¶еҫ—AlпјҲOHпјү3 пјҢ йңҖиҰҒд»ҺдёӢеҲ—иҜ•еүӮдёӯйҖүжӢ©дёӨз§ҚпјҢйҖүз”Ёзҡ„иҜ•еүӮз»„еҗҲжңҖеҘҪзҡ„жҳҜгҖҖ гҖҖпјҺ
aпјҺNaOHжә¶ж¶І bпјҺж°Ёж°ҙ cпјҺCO2 dпјҺзӣҗй…ё
пјҲ5пјүеӣӣж°ўй“қй”ӮпјҲLiAlH4пјүжҳҜжңүжңәеҗҲжҲҗдёӯйҮҚиҰҒзҡ„иҝҳеҺҹеүӮпјҢжә¶и§ЈдәҺNaOHжә¶ж¶Іж—¶дә§з”ҹдёҖз§Қж— иүІж°”дҪ“пјҢиҜ·е®ҢжҲҗдёӢеҲ—зҰ»еӯҗж–№зЁӢејҸпјҺLiAlH4+ =гҖҖ гҖҖпјҺ
пјҲ6пјүжҹҗMgп№ЈAlеҗҲйҮ‘жҳҜдёҖз§ҚжҪңеңЁзҡ„иҙ®ж°ўжқҗж–ҷ.73.2gиҜҘеҗҲйҮ‘жҒ°еҘҪжә¶и§ЈдәҺ1.4L 5.0molвҖўLп№Ј1 HClжә¶ж¶ІпјҢеҲҷеҗҲйҮ‘дёӯMgе’ҢAlзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә пјҺ
еҚ•иҙЁ  ж°§еҢ–зү©
ж°§еҢ–зү© 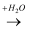 й…ёжҲ–зўұ
й…ёжҲ–зўұ 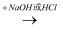 зӣҗпјҺ
зӣҗпјҺ
 Al2O3+2FeеҸҜз”ЁдәҺй“ҒиҪЁзҡ„з„ҠжҺҘпјҢиҜҘеҸҚеә”еұһдәҺпјҲВ В пјү
Al2O3+2FeеҸҜз”ЁдәҺй“ҒиҪЁзҡ„з„ҠжҺҘпјҢиҜҘеҸҚеә”еұһдәҺпјҲВ В пјү

дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
в‘ й…ёзўұдёӯе’ҢеҸҚеә”з”ҹжҲҗзӣҗе’Ңж°ҙпјҢжүҖд»Ҙз”ҹжҲҗзӣҗе’Ңж°ҙеҸҚеә”дёҖе®ҡжҳҜдёӯе’ҢеҸҚеә”пјӣ
в‘Ўж°§еҢ–зү©дёӯеҗ«жңүж°§е…ғзҙ пјҢжүҖд»Ҙеҗ«жңүж°§е…ғзҙ зҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜж°§еҢ–зү©пјӣ
в‘ўйҮ‘еұһй“қдёҺзӣҗй…ёеҸҚеә”з”ҹжҲҗAlCl3е’ҢH2 пјҢ жүҖд»ҘйҮ‘еұһй“ҒдёҺзӣҗй…ёеҸҚеә”з”ҹжҲҗFeCl3е’ҢH2пјӣ
в‘Јжө“зӣҗй…ёиҜ•еүӮ瓶ж•һеҸЈд№…зҪ®еҗҺеҸҳзЁҖдё”иҙЁйҮҸеҮҸиҪ»пјҢжүҖд»Ҙжө“зЎ«й…ёж•һеҸЈд№…зҪ®д№ҹеҸҳзЁҖдё”иҙЁйҮҸеҮҸиҪ»пјҺ
 вҖқ иЎЁзӨәеҸҚеә”дёҖжӯҘе®ҢжҲҗ)е…ізі»иҪ¬еҢ–зҡ„жҳҜ пјҲ пјү
вҖқ иЎЁзӨәеҸҚеә”дёҖжӯҘе®ҢжҲҗ)е…ізі»иҪ¬еҢ–зҡ„жҳҜ пјҲ пјүйҖүйЎ№ | a | b | c |
A | SiO2 | Na2SiO3 | H2SiO3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Fe | Fe(OH)3 | Fe2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
зү©иҙЁ | зү©иҙЁ | зү©иҙЁ | |
A | Cl2 | Al | NaOH(aq) |
B | NH3 | O2 | H2SO3(aq) |
C | SO2 | (NH4)2SO3(aq) | Ca(OH)2 |
D | Cu | FeCl3(aq) | HNO3 |
в‘ Si в‘ЎAl(OH)3 в‘ўNaHCO3 в‘ЈAl2O3 в‘ӨNa2CO3
-
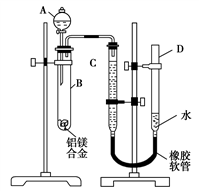
пјҲ1пјү AдёӯиҜ•еүӮдёәгҖӮ
-
пјҲ2пјү е®һйӘҢеүҚпјҢе…Ҳе°Ҷй“қй•ҒеҗҲйҮ‘еңЁзЁҖй…ёдёӯжөёжіЎзүҮеҲ»пјҢе…¶зӣ®зҡ„жҳҜгҖӮ
-
пјҲ3пјү жЈҖжҹҘж°”еҜҶжҖ§пјҢе°ҶиҚҜе“Ғе’Ңж°ҙиЈ…е…Ҙеҗ„д»ӘеҷЁдёӯпјҢиҝһжҺҘеҘҪиЈ…зҪ®еҗҺпјҢйңҖиҝӣиЎҢзҡ„ж“ҚдҪңиҝҳжңүпјҡв‘ и®°еҪ•Cзҡ„ж¶ІйқўдҪҚзҪ®пјӣв‘Ўе°ҶBдёӯеү©дҪҷеӣәдҪ“иҝҮж»ӨпјҢжҙ—ж¶ӨпјҢе№ІзҮҘпјҢз§°йҮҚпјӣв‘ўеҫ…BдёӯдёҚеҶҚжңүж°”дҪ“дә§з”ҹ并жҒўеӨҚиҮіе®Өжё©еҗҺпјҢи®°еҪ•Cзҡ„ж¶ІйқўдҪҚзҪ®пјӣв‘Јз”ұAеҗ‘Bдёӯж»ҙеҠ и¶ійҮҸиҜ•еүӮгҖӮдёҠиҝ°ж“ҚдҪңзҡ„йЎәеәҸжҳҜ(еЎ«еәҸеҸ·)пјӣи®°еҪ•Cзҡ„ж¶ІйқўдҪҚзҪ®ж—¶пјҢйҷӨе№іи§ҶеӨ–пјҢиҝҳеә”гҖӮ
-
пјҲ4пјү BдёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ5пјү иӢҘе®һйӘҢз”Ёй“қй•ҒеҗҲйҮ‘зҡ„иҙЁйҮҸдёәa gпјҢжөӢеҫ—ж°ўж°”дҪ“з§Ҝдёәb mL(е·ІжҚўз®—дёәж ҮеҮҶзҠ¶еҶө)пјҢBдёӯеү©дҪҷеӣәдҪ“зҡ„иҙЁйҮҸдёәc gпјҢеҲҷй“қзҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёәгҖӮ
-
пјҲ6пјү е®һйӘҢиҝҮзЁӢдёӯпјҢиӢҘжңӘжҙ—ж¶ӨиҝҮж»ӨжүҖеҫ—зҡ„дёҚжә¶зү©пјҢеҲҷжөӢеҫ—й“қзҡ„иҙЁйҮҸеҲҶж•°е°Ҷ(еЎ«вҖңеҒҸеӨ§вҖқвҖңеҒҸе°ҸвҖқжҲ–вҖңдёҚеҸ—еҪұе“ҚвҖқ)гҖӮ
| йҖүйЎ№ | иЎЁиҝ°в… | иЎЁиҝ°в…Ў |
| A | еёёжё©дёӢй“қеңЁжө“зЎ«й…ёдёӯеҸ‘з”ҹй’қеҢ– | еҸҜз”Ёй“қж§ҪиҪҰеҜҶе°ҒиҝҗйҖҒжө“зЎ«й…ё |
| B | SO2жңүжјӮзҷҪжҖ§ | SO2йҖҡе…Ҙе“Ғзәўжә¶ж¶ІдёӯпјҢжә¶ж¶ІиӨӘиүІ |
| C | зғӯзЁіе®ҡжҖ§пјҡNa2CO3пјһNaHCO3 | еҗҢжө“еәҰжә¶ж¶ІзўұжҖ§пјҡNa2CO3пјһNaHCO3 |
| D | йқһйҮ‘еұһжҖ§пјҡFпјһCl | ж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§пјҡHFпјһHCl |
 еҸҜд»Ҙиө·еҲ°жқҖиҸҢе’ҢжҠ—ж°§еҢ–зҡ„дҪңз”Ё
D . ж°Ҝж°”гҖҒиҮӯж°§гҖҒдәҢж°§еҢ–ж°ҜйғҪеҸҜз”ЁдәҺйҘ®з”Ёж°ҙзҡ„ж¶ҲжҜ’
еҸҜд»Ҙиө·еҲ°жқҖиҸҢе’ҢжҠ—ж°§еҢ–зҡ„дҪңз”Ё
D . ж°Ҝж°”гҖҒиҮӯж°§гҖҒдәҢж°§еҢ–ж°ҜйғҪеҸҜз”ЁдәҺйҘ®з”Ёж°ҙзҡ„ж¶ҲжҜ’



